2022-02-09 17:35
作者 洪亚天、王启

京港感染论坛
十年京港,逐梦感染病精准诊疗
多黏菌素类药物是由广泛分布于土壤的多黏芽孢杆菌产生的一种聚阳离子多肽,根据化学结构的不同可分为A、B、C、D和E五个家族成员。目前临床所使用的多黏菌素类主要为多黏菌素B(polymyxin B, PMB)和多黏菌素E(colistin, CST, 又称黏菌素,本文中称为黏菌素)[1,2]。该类药物于20世纪50年代末开始应用于临床,其通过破坏革兰阴性菌外膜完整性而起抗菌作用(图1),对大部分需氧革兰阴性菌具有强大的抗菌活性,但因其具有一定肾毒性和神经毒性,同时由于各类新的抗菌药物的不断研制,多粘菌素类药物逐渐退出临床[3]。近年来由于广谱抗菌药物的大量使用,多重耐药革兰阴性杆菌的分离率逐年升高(CARSS官网http://www.carss.cn/Report/Details/808),多黏菌素类药物作为重要的“最后防线类”药物再次应用于临床一线[4]。
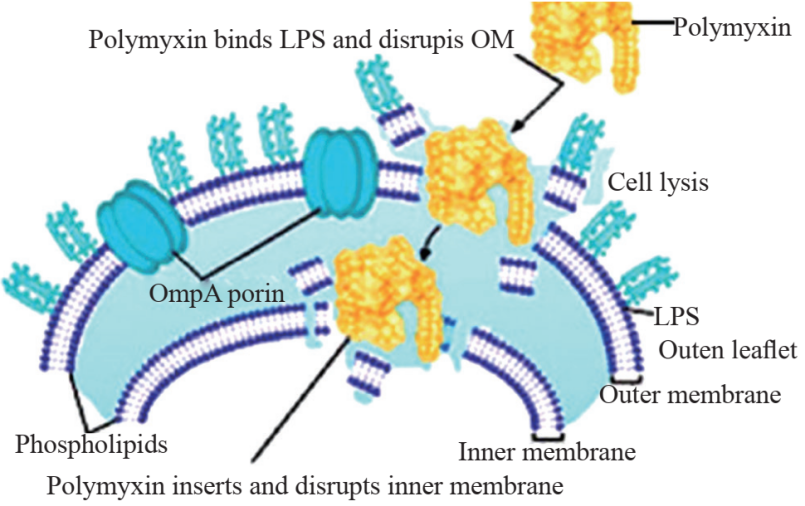
图1 多黏菌素作用于LPS,增加细菌外膜的通透性[5]
对于多黏菌素类药物的敏感性试验,美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)和欧洲药敏试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)推荐微量肉汤稀释法(broth microdilution method,BMD)作为测定肠杆菌目细菌、铜绿假单胞菌和不动杆菌属对多黏菌素类药物体外敏感性的参考方法。由于多黏菌素分子量大,在琼脂内不易扩散,故不推荐琼脂稀释法、纸片扩散法和浓度梯度扩散法(Etest条)进行检测。2020年的CLSI M100-S30文件中新增加了两个检测方法,即黏菌素肉汤纸片洗脱法(colistin broth disk elution,CBDE)和黏菌素琼脂实验(colistin agar test,CAT),可用于确定多黏菌素E对肠杆菌目和铜绿假单胞菌的最低抑菌浓度(Minimum inhibitory concentration,MIC)值,但不适用于不动杆菌属。其中CBDE方法操作简易,省时省力,可在实验室日常工作中开展,是目前CLSI推荐的重复性和准确性均较好的药敏方法。黏菌素和多黏菌素B被认为是等效的药物,因此从测试黏菌素中获得的MIC可以预测多黏菌素B的MIC值,反之亦然。
2020年美国CLSI变更了多黏菌素的判定折点,取消了多黏菌素敏感折点,仅报告中介(I≤2mg/L)与耐药(R≥4mg/L),并增加了备注信息,即在使用黏菌素及多黏菌素B时,需要给予负荷剂量,并根据肾功能给与最大剂量;强调对于肺炎患者黏菌素或多黏菌素B即时全身给药,亦很可能无效。而EUCAST则建议采用敏感(S≤2mg/L、R>2mg/L)作为判定折点(表2)。CLSI认为即使依照折点判断药物敏感性结果获得“中介”结果时,多黏菌素的临床效力亦有限,因此强烈推荐使用多黏菌素的替代用药,即使使用多黏菌素时也应与一种或多种抗菌药物联合用药[6,7]。
表2 多黏菌素药物敏感性试验折点[8]
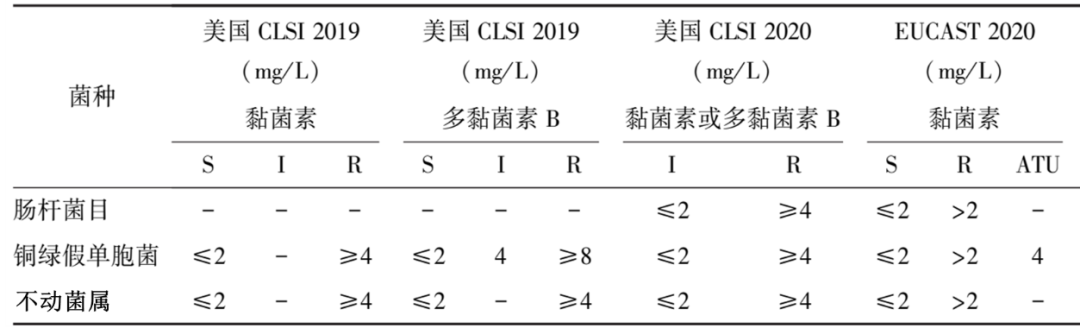
S:敏感(Susceptible);I:中介(Intermediate);R:耐药(Resistant);ATU:技术不确定区(Aera of technical uncertainty)
为正确指导多黏菌素的合理应用,美国感染病学会(Infectious Diseases Society of America,IDSA)等6家学会于2019年联合发布了多黏菌素合理应用的国际共识指南,其中根据指南推荐:
(1)黏菌素的PK/PD治疗推荐靶值为稳态时24h血浆药时曲线下面积(AUC ss,24h)达到50mg·h/L,即稳态时平均血药浓度(Css,avg)达到2mg/L,该浓度已被认为是能耐受的最高暴露量,高于此浓度将增加急性肾损伤的发生率和严重性。有证据显示多黏菌素B的AUCss,24h靶值达到50~100mg·h/L,相当于Css,avg2~4 mg/L,从毒性反应的角度是可以接受的。
(2)在黏菌素的静脉给药方案中,2mg/L是较为适宜的目标稳态血药浓度值,也是能耐受的最高暴露量;但对于肺部感染,这个浓度可能无法达到理想的治疗效果。对于多黏菌素B,指南推荐的目标稳态血药质量浓度为2~4mg/L,4mg/L被认为是其能耐受的最高暴露量,高于此浓度将增加急性肾损伤的发生率和严重程度。
(3)由于2种多黏菌素类药物治疗窗狭窄,为优化其临床使用并降低肾毒性,通常需要采用治疗药物浓度监测(Therapeutic drug monitoring,TDM)服务来提高其临床应用的安全性和有效性。
(4)对耐碳青霉烯类肠杆菌目细菌、鲍曼不动杆菌或铜绿假单胞菌引起的侵袭性感染达成以下共识:静脉注射多黏菌素类药物时,应与其他敏感药物两药或三药联合,并对此作了二级推荐[9]。
虽然联合用药一直存在争议,但丰富的临床前数据表明多黏菌素联合疗法既能增强杀菌作用,又能减少多黏菌素耐药性及肾毒性的出现[10,11]。Lima等[12]发现,联合使用氯霉素和多黏菌素可有效抑制阴沟肠杆菌黏菌素耐药株和诱导耐药株,联合用药时黏菌素的MIC值显著低于单药用药时的MIC值,两种药物具有协同作用。胡帮芹等[13]通过Meta分析评估了多黏菌素或替加环素单药与联合治疗对碳青霉烯类耐药肺炎克雷伯菌(Carbapenem resistant Klebsiella pneumoniae , CRKP)血流感染的有效性,结论表明以多黏菌素为基础的联合治疗组较单药组能够降低CRKP菌血症患者的全因死亡率。梅清等[14]评价了头孢他啶/阿维巴坦(CAZ/AVI)单用或联合多黏菌素E(COL)对临床分离的泛耐药铜绿假单胞菌(Extensively drug-resistant Pseudomonas aeruginosa,XDR-PA)的体外抗菌活性,结果显示CAZ/AVI联合COL可以有效提高两药单用对XDR-PA的杀菌效应,减少耐药菌的产生,抑制生物膜的形成,是治疗XDR-PA感染的潜在方案。
伴随着多黏菌素的应用,其耐药菌株在世界范围内迅速出现,对其耐药机制的研究已成为一项热点问题。多黏菌素获得性耐药机制主要包括染色体介导和质粒介导的可移动黏菌素耐药基因mcr 导致[15]。
(1)染色体介导的耐药性:耐药菌主要通过对外膜脂多糖(LPS)结构进行修饰改造,其中涉及phoPQ,pmrAB,mgrB等的基因突变。除此之外还包括外排泵系统的孔蛋白突变和过表达、荚膜多糖的产生、黏菌素灭活酶等。
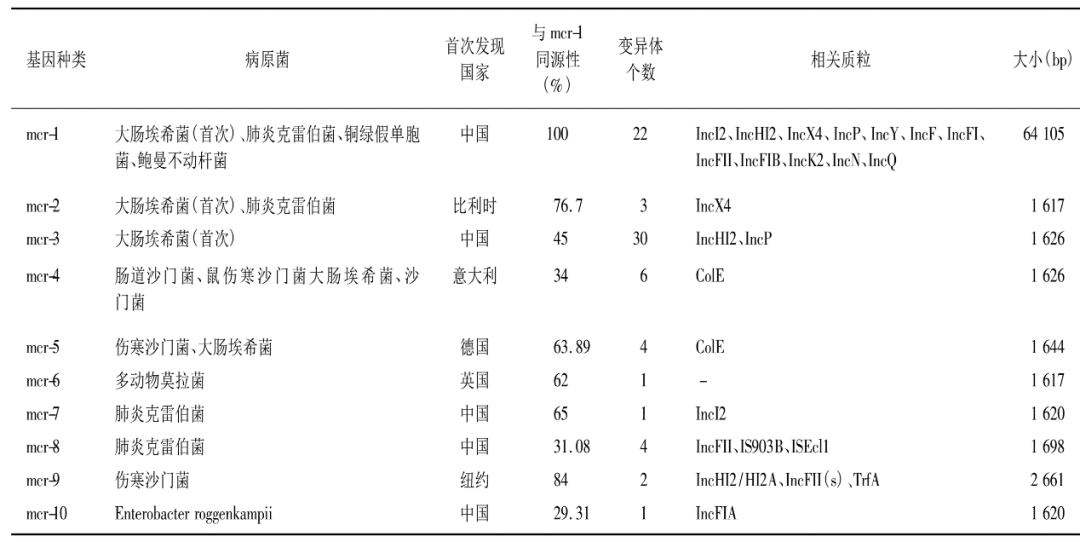
(2)质粒介导的耐药性:长期以来对多黏菌素耐药的机制均被归因于染色体突变,但这种耐药性不会在细菌间进行传播,不具备广泛流行的特点。直到2015年,中国学者在对食用动物大肠埃希菌抗生素耐药性例行监测时鉴定出第一个质粒介导的黏菌素可移动耐药基因mcr ,命名为mcr-1。该基因可在不同菌株间传播,也可在农场动物的粪便、食物和环境样本中广泛传播。2020年,mcr-10在细菌Enterobacter roggenkampii 的质粒上得到鉴定,目前在革兰阴性杆菌中共发现10个不同变异体(表3)[16]。根据《多黏菌素与替加环素及头孢他啶/阿维巴坦药敏方法和报告专家共识》[17]中推荐,有条件的实验室可以采用实验室自建方法(Laboratory developed test,LDT)—如多重PCR检测mcr-1到mcr-5基因。通常mcr 基因阳性结果考虑耐药,而阴性结果不排除耐药。相较于染色体传播,质粒介导使得mcr 基因的传播更具广泛性。庆幸的是,目前mcr 基因的检出率并不高[18]。
表3 可移动黏菌素耐药基因mcr 变异体[16]
多黏菌素作为最后防线类药物,在治疗耐药菌感染中发挥着重要作用,但其肾毒性及神经毒性的存在不容忽视,以及耐药菌株的不断出现都是一些需要应对的挑战。在临床治疗中需合理审慎的使用多黏菌素,避免耐药基因的流行,确保其收益大于风险,任重而道远。
参考文献(上下滑动)
[1] Cai Y, Lee W, Kwa AL. Polymyxin B versus colistin: An update[J]. Expert review of anti-infective therapy, 2015. 13(12): p. 1481-1497.
[2] Brink, AJ, Richards GA, Colombo G, et al. Multicomponent antibiotic substances produced by fermentation: Implications for regulatory authorities, critically ill patients and generics [J]. Inter J Antimicrob Agents, 2014. 43(1): p. 1-6.
[3] Poirel L,Jayol A , Nordmann P. Polymyxins: Antibacterial Activity, Susceptibility Testing, and Resistance Mechanisms Encoded by Plasmids or Chromosomes[J]. Clinical Microbiology Reviews, 2017. 30(2): p. 557.
[4] 乔涵, 游雪甫,李聪然. 多黏菌素抗菌机理及耐药机制研究进展 [J].中国抗生素杂志, 2019. 44(7): 8.
[5] Velkov T, Thompson P E, Nation R L,et al. Structure-Activity Relationships of Polymyxin Antibiotics. [J].Journal of Medicinal Chemistry, 2010. 53(5): p. 1898-1916.
[6] Errata, N, E. Pseudomonas and S. Groups. European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters. 2010.
[7] Clinical and Laboratory Standard Institute. Performance standards for Antimicrobial Susceptibility Testing [M].30 th Edition.USA:Wayne,2020:38-48.
[8] 杨启文,马筱玲,胡付品等, 多黏菌素药物敏感性检测及临床解读专家共识. [J].协和医学杂志, 2020. 11(5): 12.
[9] Tsuji, B T, Jason M P,Alexandre P Z,et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP)[J].Pharmacotherapy, 2019. 39(1): p. 10-39.
[10] Bergen, P J,Smith NM,Bedard TB, et al. Rational Combinations of Polymyxins with Other Antibiotics Polymyxin Antibiot: From Lab Bench Beside, 2019:1145:251-288.
[11] Lenhard, J R, Nation R L, Tsuji B T, Synergistic combinations of polymyxins [J]. International Journal of Antimicrobial Agents, 2016: p. 607-613.
[12] Lima TB, Silva ON, De Almeida KC, et al.Antibiotic combinations for controlling colistin-resistant Enterobacter cloacae[J]. J Antibiot (Tokyo), 2017. 70(2): p. 122-129.
[13] 胡帮芹,杨忆,赵洪琼等. 替加环素与多黏菌素单药或联合治疗碳青霉烯类耐药肺炎克雷伯菌血流感染有效性的Meta分析[J].临床药物治疗杂志, 2019. 17(02): 39-45.
[14] 梅清,耿士窠,房晓伟等. 头孢他啶-阿维巴坦联合多黏菌素E对广泛耐药铜绿假单胞菌的体外抗菌活性[J]. 中华危重病急救医学, 2019. 31(10): 1212-1218.
[15] Leshaba, T, Mbelle NM ,Osei SJ. Current and emerging polymyxin resistance diagnostics: A systematic review of established and novel detection methods[J]. J Appl Microbiol, 2021. 132(1): 8-30.
[16] 李立,叶璟,胡蕾等. 多黏菌素耐药性研究进展[J].医学综述, 2021. 27(17): 第7页.
[17] 中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组与中华医学会微生物学与免疫学分会临床微生物学组, 多黏菌素类与替加环素及头孢他啶/阿维巴坦药敏方法和报告专家共识[J]. 中华检验医学杂志, 2020(10): 第964-972页.
[18] 宗劲, 徐凯进, 黄莹等. 质粒介导黏菌素耐药机制研究进展[J]. 中国微生态学杂志, 2021. 33(01): 120-125.
作者简介

洪亚天
南开大学微生物学硕士,现任济南市中心医院医学实验诊断中心主管技师,从事临床微生物检验工作多年,社会兼职为山东省医师协会重症感染医师分会临床微生物学组委员。

王启
副主任技师,毕业于北京大学医学部,临床检验诊断学专业。2009年至今工作于北京大学人民医院检验科,师从北京大学人民医院检验科王辉教授。主要从事细菌耐药监测,感染性疾病的实验室诊断工作。主要研究方向为碳青霉烯耐药的肠杆菌科细菌流行病学与耐药机制。负责具体实施中国美罗培南敏感性监测(CMSS)工作。主持国家自然科学基金1项,北京大学人民医院院内发展基金1项。以第一作者在感染及临床微生物领域Clinical Infectious Disease, Antimicrobial Agents and Chemotherapy等杂志上发表论文多篇。
END
作者|洪亚天(济南市中心医院),王启(北京大学人民医院)
审校|王晓娟


