2022-05-26 11:08
作者 张敏、张秋莹

京港感染论坛
十年京港,逐梦感染病精准诊疗
肠球菌是人类和陆生动物微生态菌群的一部分,其中粪肠球菌和屎肠球菌已成为医院感染的重要多重耐药菌。肠球菌具有高度可塑性的基因组,可作为物种间基因转移的枢纽,比如把万古霉素耐药的基因传递给耐甲氧西林金黄色葡萄球菌。不同于其他革兰阳性菌如链球菌属、葡萄球菌属和梭菌属,肠球菌尚未发现针对人类和动物细胞的特异性蛋白毒素。2022年3月,Xiaozhe Xiong,Songhai Tian,Pan Yang等学者发表在《Cell》上的一篇文章,从全球分离的粪肠球菌、屎肠球菌和小肠肠球菌(E.hirae)中发现一种新的成孔毒素家族—肠球菌成孔毒素(enterococcus pore-forming toxins,Epxs),该毒素以MHC/HLA-1作为受体。
成孔毒素(pore-forming toxins,PFTs)是最常见的一类细菌毒素,它是一种特殊的膜靶向蛋白,通过在细胞膜上形成孔隙发挥毒性作用,可以导致上皮屏障破坏、免疫细胞失活、组织损伤。PFTs依据其成孔过程中的跨膜结构可分为α- PFTs(跨膜区结构为α-螺旋)和β- PFTs(跨膜区结构为β-桶结构),其中β- PFTs又包括溶血素家族和胆固醇依赖的溶细胞素家族,前者形成小孔隙,后者形成大孔隙。各种细菌病原体通过分泌一类特异性的蛋白,形成具有特异性β-桶结构的跨膜低聚孔,攻击靶细胞膜,影响细胞膜的通透性,最终导致细胞死亡。尽管β-桶状PFTs在体外高浓度下可以形成非特异性气孔,但已有研究发现了其特异性的宿主蛋白受体,不同的PFTs在靶细胞膜上具有各自特定的受体,受体的发现在确定毒素宿主种类和细胞类型选择性方面起到关键作用。
该研究采用了包括肠球菌分离、测序和生物信息学分析等一系列方法,从肠球菌中分离并鉴定出一种新的肠球菌毒素——成孔毒素家族(Epxs)。结构研究显示Epxs 具有独特的帽状结构域和跨膜孔结构域,其帽状结构域顶部出现β桶状通道时形成β--桶状成孔毒素,通过监测从动物和环境中收集的肠球菌基因组确定了两个与溶血素家族成员同源的未被鉴定过的β-桶状PFTs。
该研究结果如下:从来自鸡肉和马粪便的粪肠球菌中分别发现了一个潜在的小孔β桶状PFTs基因,并将其分别命名为肠球菌成孔毒素1和2(Epx1和Epx2)。在数据库中搜索还发现了另外六种同源物(Epxs3-8)。这些Epxs彼此之间有40%-89%的同源性,并与其他PFT形成单独的一个分支(如图1A所示)。
从跨越五大洲不同来源的标本分离出来的粪肠球菌中鉴定出Epx1和Epx3,屎肠球菌中鉴定出Epx2和Epx7,小肠肠球菌(E.hirae)中鉴定出Epx4、Epx5、Epx6和Epx8(如图1B-1C所示)。将这些分离株的基因组与粪肠球菌的参考基因组进行比对(图1D),屎肠球菌(图1E)和E. hirae (图1F)显示携带Epx的不是单个菌株,可能是混合菌株。四种细胞毒性Epxs毒素中,Epx2对HeLa细胞表现出最强的细胞毒性作用(图1H),四种Epxs均能诱导人工脂质体在体外裂解(图1I),脂质体促进了类似于其他PFTs的耐十二烷基硫酸钠(SDS)低聚物的形成(图1 j)。Epx4是具有八聚体组蛋白孔隙的晶体结构,由帽状结构域、边缘结构域以及形成跨膜β-桶状孔茎结构域组成(图2A-E)。Epx1的八聚体气孔结构在平面脂质双分子层上有电导特性,逐步形成多个孔。Epx1和Epx4的顶部结构域带电残基介导原聚体间相互作用(图3E),Epx2中的带电残基(K50E和K50E/K56E)导致SDS抗性低聚物的形成被破坏,并降低了其对HeLa细胞的毒性(图3F)。通过全基因组CRISPR-Cas9筛选明确了MHC/HLA-I为两个成员(Epx2和Epx3)的受体,并发现人、马、牛和猪的HLA-I复合体均可作为Epxs的受体,但不包括小鼠。
携带Epx2毒素的屎肠球菌可诱导外周血单核细胞(PBMCs)凋亡,干扰素(IFN-γ)使人类细胞和肠道脏器对Epx2和Epx3敏感,会损伤人体PBMCs和肠道脏器。而这种损伤作用可被Epx2抗体中和,IFN-γ提高MHC-I表达的同时增强了Epx2和Epx3对人类细胞和肠道脏器的毒性。
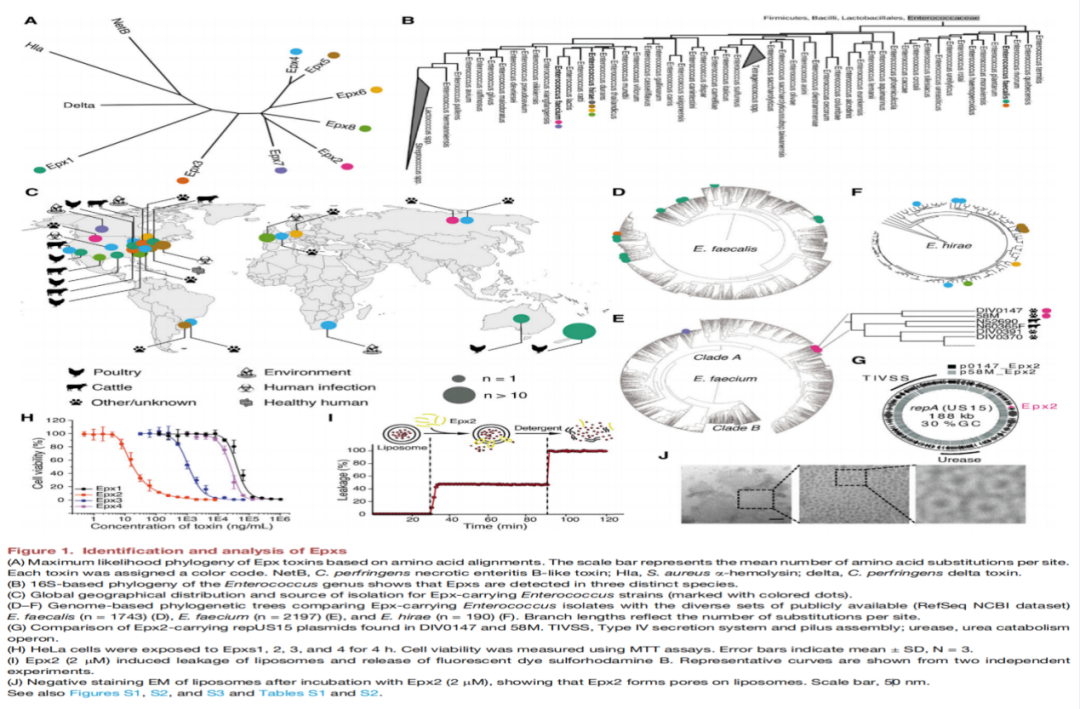
▲ 图1成孔毒素家族的鉴定与分析
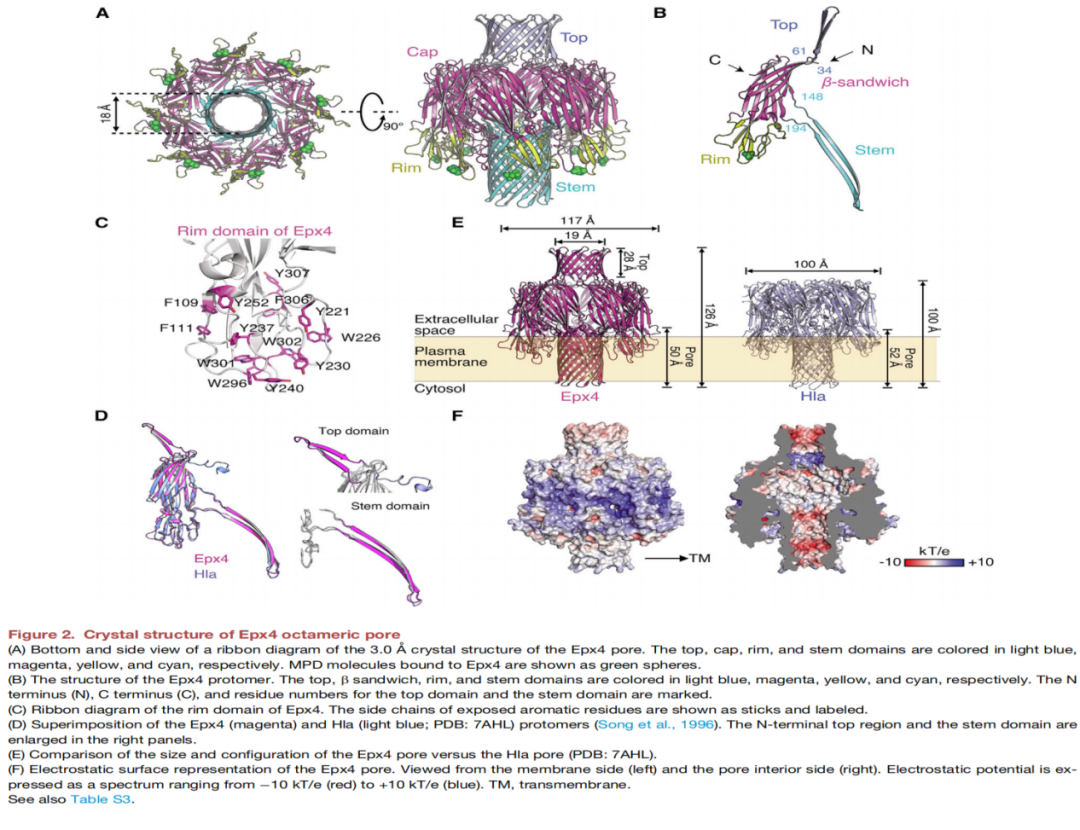
▲ 图2 成孔毒素Epx4八聚物孔的晶体结构
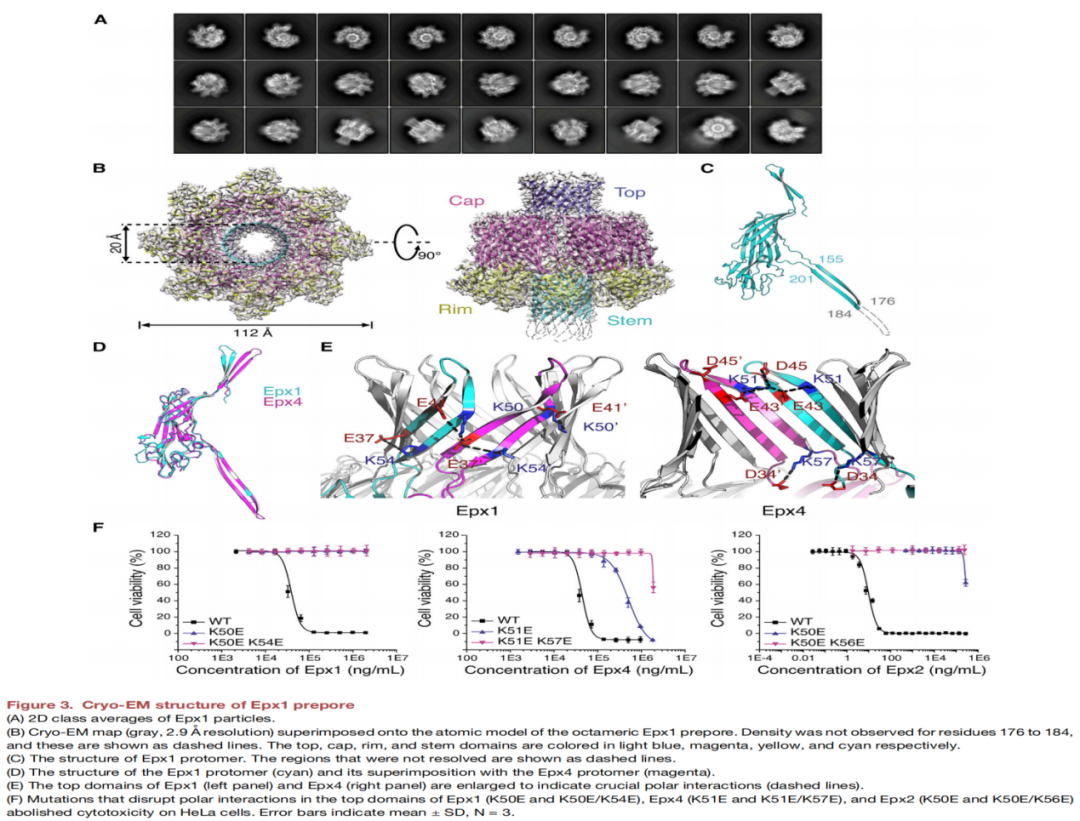
▲ 图3 成孔毒素Epx1预孔的低温- em结构
肠球菌中的β-桶状PFTs成员对人类细胞具有高度毒性,由于广泛的地理分布、宿主的多样性以及多种独立引入不同物种获得这一毒素家族并不少见,可能会带来竞争优势。其功能特征显示了携带毒素的屎肠球菌的致病力强,Epx2在免疫抑制和上皮屏障破坏过程中起关键作用。PFTS的常见功能包括破坏上皮屏障功能和逃避宿主免疫反应,这有助于细菌生长和扩散,使这种毒素成为开发新的毒力靶向疗法的重要目标,这些疗法可能对人类病原体具有广泛的活性。
PFTs是近年来研究较多的细菌毒素之一,大量研究阐明了其复杂的分子机制,尤其是受体MHC/HLA-1的发现使我们能更好地探究PFTs的生物学功能及其对人类细胞的特异性作用。然而仍有一些问题值得进一步探讨,例如细菌携带Epxs的致病性和Epxs的作用机制还有待在动物感染模型中进行体内研究和验证,Epx1和Epx4对测试细胞未显示高毒力,Epxs和共生菌是否会导致人或动物致病?PFTs的众多研究使我们对于其在肠球菌致病分子机制中的作用有了更加深刻的认识,也使我们意识到PFTs可作为开发新的毒力靶向疗法的重要目标,相信将来对人类由携带PFTs肠球菌感染的疾病能得到有效控制。
文章链接:https://doi.org/10.1016/j.cell.2022.02.002

张 敏
硕士毕业于湖北医药学院。现就职于湖北省随州市中心医院检验科,从事临床微生物检验相关工作。在国家级核心期刊发表多篇论文。

张秋莹
湖北省随州市中心医院检验科 临床微生物室 副主任检验师;湖北省微生物学会分析微生物专业委员会青年委员;湖北医药学院第五临床学院检验系讲师;湖北医药学院第五临床学院医学检验系教研实验室秘书;随州市医学会心血管病学专业委员会委员;京港感染论坛直播精选栏目版主。
END
作者|张敏(随州市中心医院)、张秋莹(随州市中心医院)
审校|余方友(上海市肺科医院)、陈宏斌(北京大学人民医院)


