2023-02-05 12:17
作者 周迎

京港感染论坛
多学科合作,构建诊断管理体系
多重耐药肺炎克雷伯菌(Multidrug-Resistant Klebsiella pneumoniae, MDR-KP)因耐药谱广、致死率高及传播速度快,给我国乃至全世界的抗感染治疗带来严峻的挑战。质粒介导的获得性耐药,是促进MDR-KP 形成的重要因素。因此,破坏和消除耐药质粒是防控MDR-KP形成的关键。CRISPR-Cas系统具备特异靶向耐药基因或质粒的特点,作为防控耐药菌形成的潜在策略备受关注。CRISPR-Cas9系统已被广泛应用于真核生物的基因编辑,然而,其在原核生物中的应用相当有限,因异源 Cas9 的表达受微生物体内异常多样的 DNA 稳态的阻碍,且对质粒等大基因组片段剪切效率较低。因此,重新利用分布广泛的内源性 CRISPR-Cas 系统正在成为原核生物中一种新的基于 CRISPR 的基因组编辑策略。
复旦大学附属华山医院蒋晓飞教授团队,联合美国Hackensack Meridian 医学院Liang Chen教授团队以及上海市肺科医院余方友教授团队,共同探索肺炎克雷伯菌所携带的天然CRISPR-Cas3系统在消除IncFII型多重耐药流行质粒的应用,为利用内源性CRISPR-Cas3系统解决肺炎克雷伯菌多重耐药问题提供有力支持。该研究发表在Lancet子刊《eBioMedicine》(中科院1区Top,2022年影响因子11.205),标题为《Exploiting a conjugative endogenous CRISPR-Cas3 system to tackle multidrug-resistant Klebsiella pneumoniae》,同济大学附属上海市肺科医院检验科周迎为该论文的第一作者,复旦大学附属华山医院蒋晓飞教授,美国Hackensack Meridian 医学院Liang Chen教授以及上海市肺科医院余方友教授为该论文的通讯作者。
原文链接:https://pubmed.ncbi.nlm.nih.gov/36696817/
![]()
该研究从NCBI公共数据库中收集并分析了932株全测序的肺炎克雷伯菌,共获得3117个质粒,其中1439个质粒被认为是耐药质粒。在这些耐药质粒中,IncFII型耐药质粒具有绝对流行优势。我们从77.52% (562/725)的IncFII质粒中鉴定出总共3327个耐药基因,这些耐药基因可几乎介导对所有常见临床抗菌药物的耐药。值得注意的是,超过90% IncFII质粒通过生物信息学分析预测为可接合性质粒,表明 IncFII 质粒上的耐药基因可以通过接合转移到其他细菌宿主。这些结果均显示,IncFII耐药质粒是介导MDR-KP形成和大规模流行的关键。
为利用内源性CRISPR-Cas3系统对IncFII质粒进行消除,我们需首先评估IncFII 质粒是否为天然 CRISPR-Cas3 系统的良好靶标。我们发现96.83% (702/725) 的质粒至少含有一个可与该CRISPR系统匹配的protospacer(图1)。值得注意的是,大多数IncFII质粒可被多个spacer靶向,超过一半的质粒(52.4%,380/725)包含11-15个匹配的protospacer(图1)。此外,我们发现CRISPR在IncFII质粒的靶向区域高度保守(图2),且这些质粒区域的失活可能会干扰质粒的稳定性,导致质粒从其细菌宿主中消失。这提示我们可利用天然 I-E 型 CRISPR-Cas3 系统控制IncFII耐药质粒的获取和稳定存在,从而减少与质粒相关的耐药性传播。
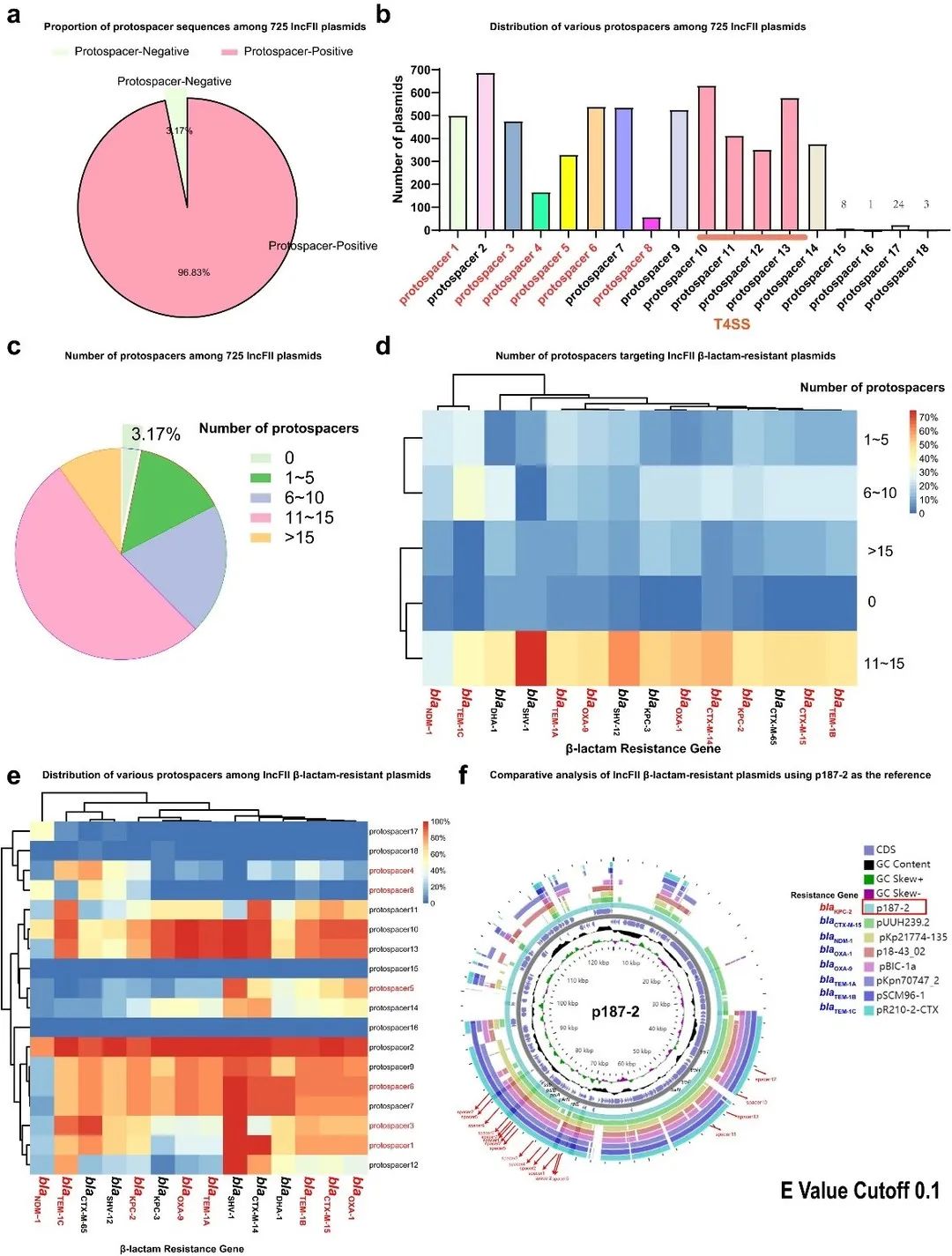
▲ 图1. IncFII质粒携带的protospacer的特点
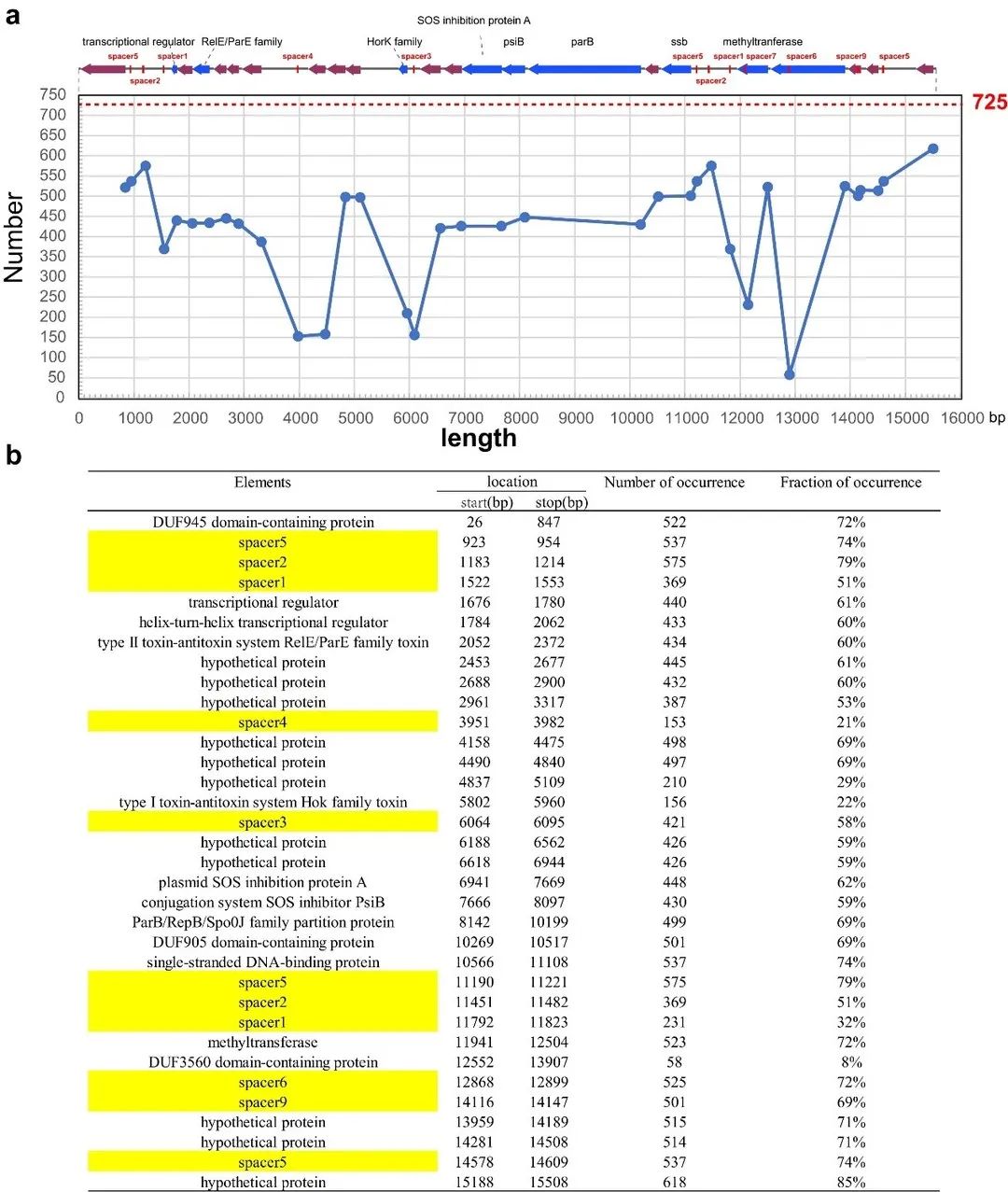
▲图2. CRISPR-Cas3系统靶向IncFII质粒的保守区域
基于对 IncFII 质粒的protospacer序列的特点分析,我们选择肺炎克雷伯菌 KP8 (CP025636.1) 携带的CRISPR-Cas3 系统进行后续的质粒消除实验。我们将该天然CRISPR系统克隆至可自主接合转移的质粒载体上,构建pCRISPR质粒免疫平台。pCRISPR 衍生自 pUC-RP4 (pEmpty) 质粒,携带 pBR322 复制原点(高拷贝)和 IncP RK2 质粒的oriT RP4(可移动)以及来自KP8的CRISPR-Cas3 系统(图3a)。为确定该pCRISPR 系统是否可以有效地将 CRISPR-Cas3系统递送至肺炎克雷伯菌,我们评估了该质粒在不同遗传背景的肺炎克雷伯菌JS187 (ST11) 和 HD5914 (ST751)的质粒接合频率。结果显示,pCRISPR 可以高接合频率自主转移至肺炎克雷伯菌中,且能在不同的宿主菌中高水平表达(图3c)。进一步研究发现, pCRISPR 在接合转移过程中可对靶质粒进行剪切消除,且具有时间依赖性。在孵育72小时之后,质粒的消除效率可达90%(图3c)。这些结果表明,我们设计的 CRISPR-Cas3 免疫平台可以通过体外接合成功递送,并介导靶质粒发生显着的链断裂,从而消除耐药质粒。
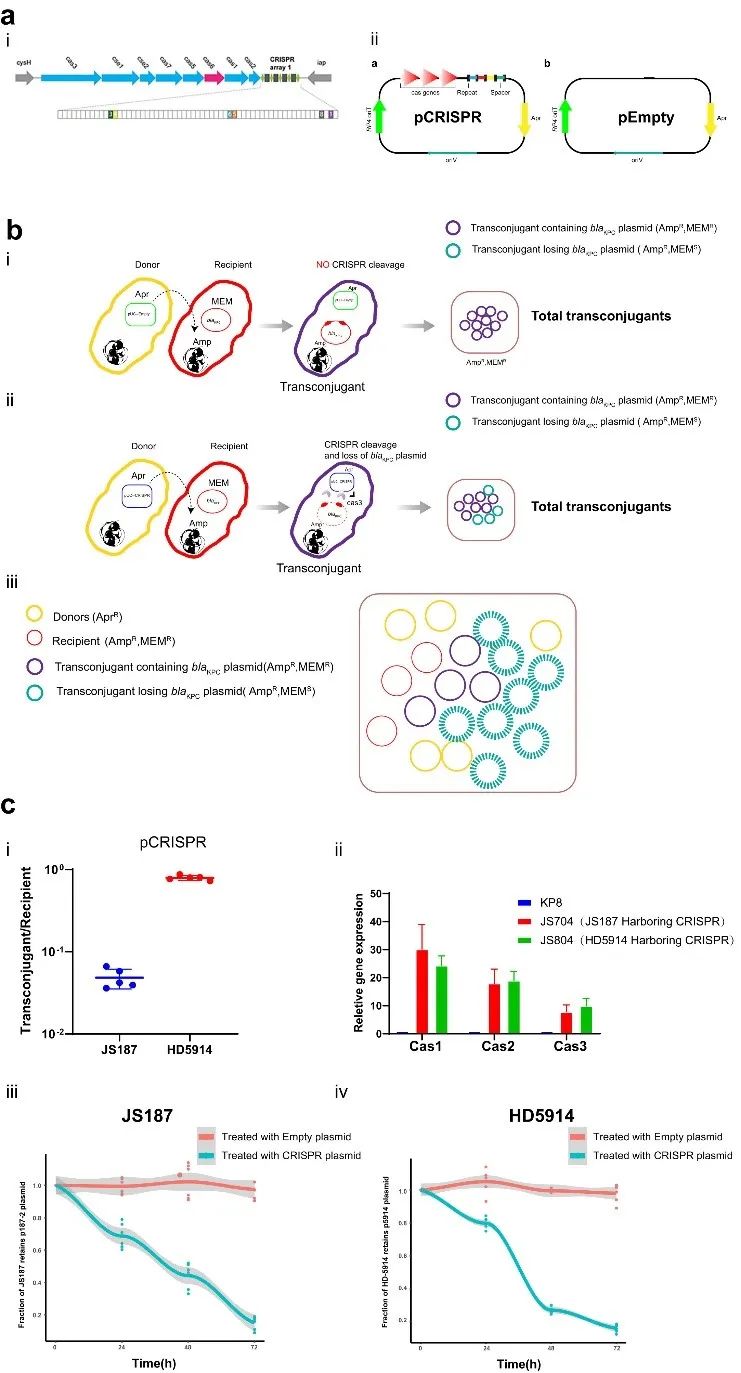
▲图3. 通过接合型质粒体外递送天然CRISPR-Cas3系统进行靶质粒消除
尽管体外质粒接合实验显示CRISPR-Cas3系统可显著消除IncFII质粒,但在该过程中依然存在一些“逃逸株”。研究显示,完全的靶质粒消除,依赖于CRISPR的累积免疫干扰。因此,我们进一步研究工程化的 CRISPR-Cas3 免疫平台是否可以在生长过程中有效地从 “逃逸株”中消除目标质粒。我们的结果显示pCRISPR可在“逃逸株”的生长过程中,有效降低靶质粒的拷贝数(图4abcd)。此外,我们还通过SI-PFGE进一步验证了pCRISPR在宿主菌中对靶质粒的有效消除(图4e)。
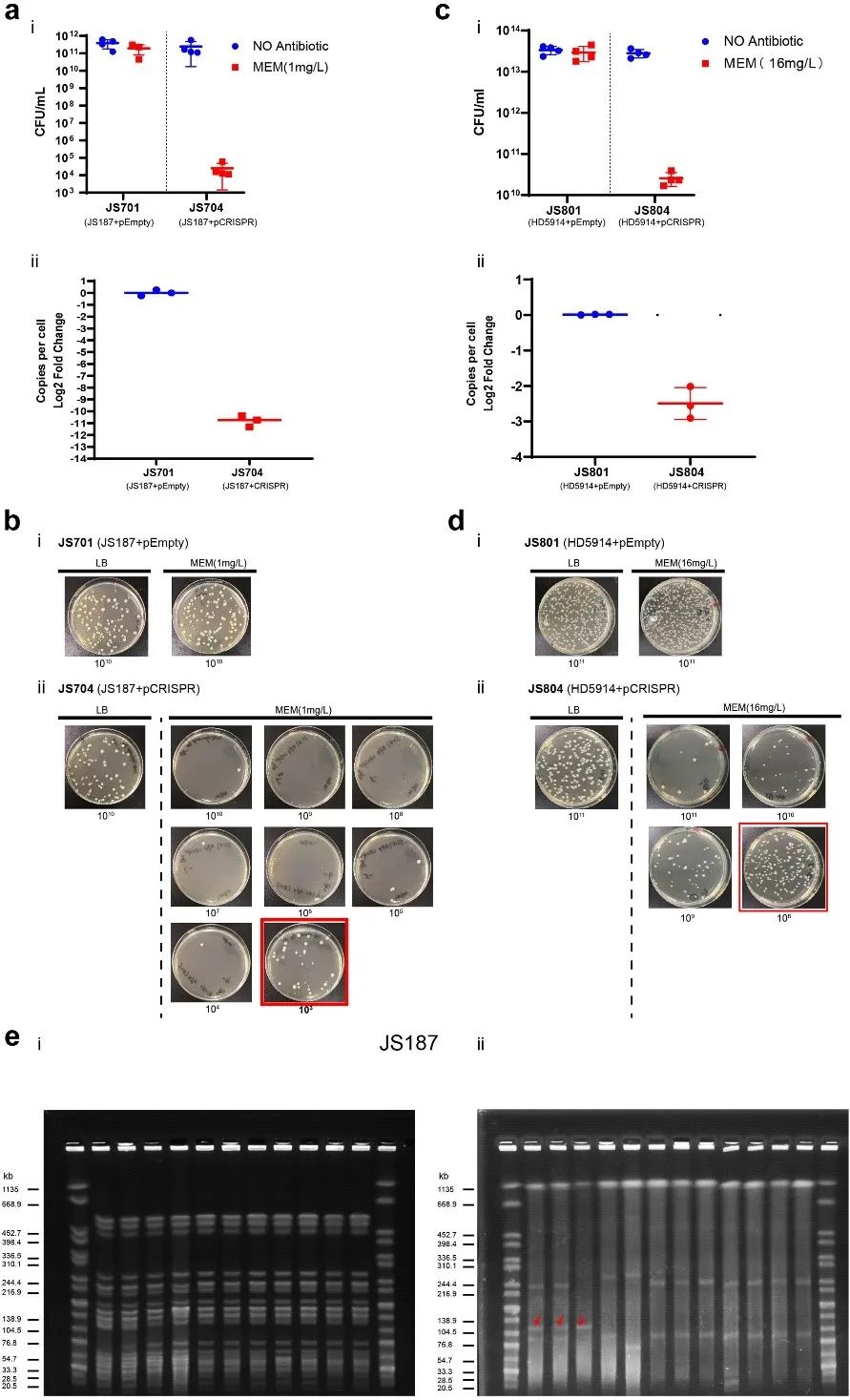
▲图4. 天然CRISPR-Cas3系统对IncFII质粒的消除
上述结果表明,体外递送的CRISPR-Cas3系统可以有效的消除IncFII质粒,我们进一步通过体外转化和接合的方式来评估是否携带pCRISPR的肺炎克雷伯菌可获得有效的免疫功能以抵制IncFII质粒的入侵。结果显示,与 CRISPR-Cas3 阴性菌株 (JS1001) 相比,JS1002携带的 CRISPR-Cas3 系统显著抑制 pACYCY-184spacer 质粒转移,而 pACYC-184control 质粒在 JS1001 和 JS1002 之间表现出相似的转化频率(图5 bi)。此外,接合实验的结果同样显示,与 CRISPR-Cas3 阴性 JS1001 相比,I-E 型 CRISPR-Cas3 的存在显著降低供体靶质粒在 JS1002 中的接合频率(图5 bii)。这些结果表明,体外获得的CRISPR-Cas3免疫平台可以为临床分离株提供抵抗IncFII质粒入侵的能力。
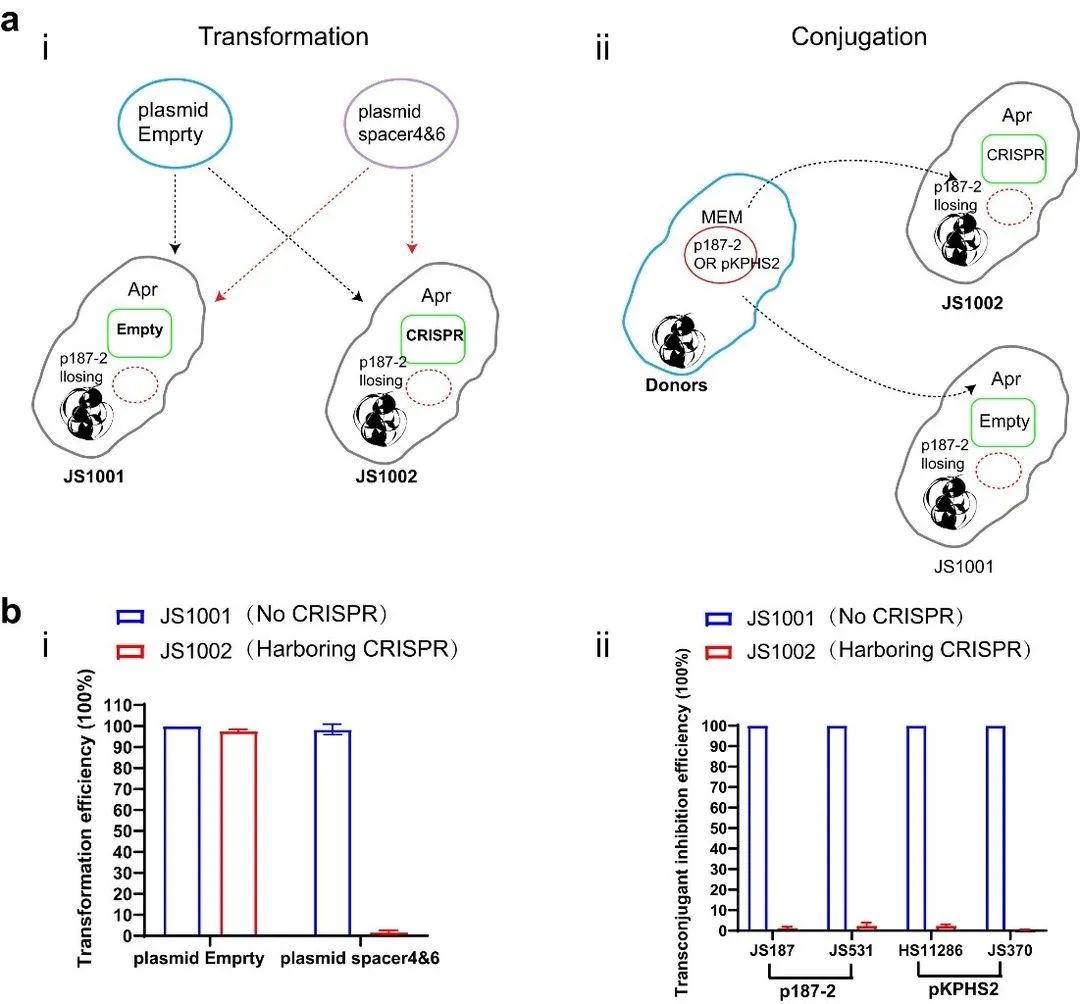
▲图5. CRISPR-Cas3平台在临床分离株中的质粒免疫
为探究天然 CRISPR-Cas3 系统是否可在体内有效的进行质粒消除,我们应用大蜡螟幼虫感染模型来评估天然 CRISPR-Cas3对体内消除 IncFII质粒的影响。我们首先将JS902(E. coli S17-1 携带 CRISPR-Cas3 系统)注射到大蜡螟中,目的是提前建立免疫屏障,2小时后注射靶标菌株JS187。我们的结果显示,与预处理生理盐水或空质粒的 JS187 感染对照相比,预注射 JS902 不仅消除了 p187-2 质粒,而且提高了幼虫存活率(图 6 a)。此外,我们还分别检查了 24、48 和 72 hpi 时的大蜡螟血淋巴细菌负荷。与空质粒相比,当用 CRISPR-Cas3 质粒预处理时,我们观察到 JS187 负荷从48小时开始快速减少,到72小时减少到几乎为0。上述结果表明,与空质粒或盐水对照相比,CRISPR-Cas3 质粒处理表现出高质粒消除效率(~100% 消除),并降低了相对毒力。相比之下,pEmpty 质粒组没有显示出对存活的明显影响(图6a )。一种合理的解释是 CRISPR-Cas3 介导的 p187-2消除降低了菌株整体致病性,而质粒 p187-2 可能携带增强JS187致病性的未知毒力因子。为明确该假说,我们通过大蜡螟幼虫模型评估了p187-2质粒的存在是否会影响菌株的致病性。结果表明,与p187-2 阴性组相比,p187-2 的存在显着增加了大蜡螟幼虫死亡率(图6d)。
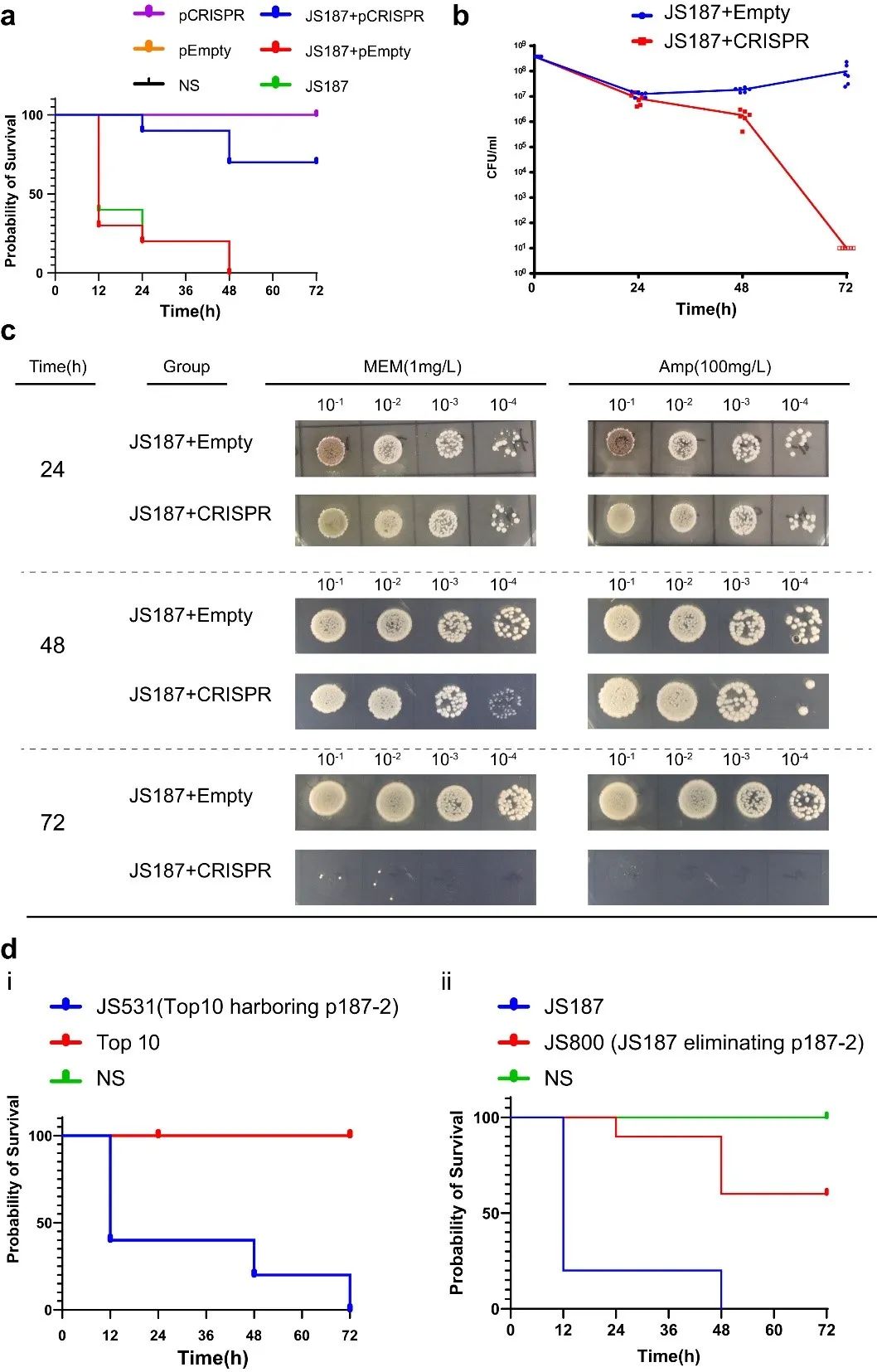
▲图6. CRISPR-Cas3系统体内消除IncFII质粒
![]()
总之,我们开发了一个肺炎克雷伯菌天然 CRISPR-Cas3 介导的质粒免疫平台,用于消除肺炎克雷伯菌中的高风险 IncFII 耐药质粒。该平台通过靶向质粒保守骨架的多个匹配的序列位点,高效消除 IncFII 耐药质粒,从而使多重耐药肺炎克雷伯菌对抗生素重新敏感。有趣的是,体内大蜡螟幼虫感染模型证明该平台不仅可以重新恢复耐药菌对抗生素的敏感性,还可以降低相对毒力。但是,该CRISPR-Cas3系统在临床干预中的应用应进一步评估。

周 迎
上海市肺科医院(同济大学附属肺科医院)检验科,医学博士,研究方向:细菌耐药和传播机制研究。主持国家自然科学基金青年基金和上海市启明星计划杨帆专项各一项,以第一作者/共同第一作者在Drug Resistance Updates, Emerging Infectious Disease, eBioMedicine Emerging Microbes & Infections, Journal of Antimicrobial Chemotherapy等权威期刊发表SCI论文12篇。

蒋晓飞
研究员,博士生导师,复旦大学附属华山医院检验医学科副主任。工作以来,主持了5项国家自然科学基金(面上项目)。第一或通讯作者发表SCI论文30篇。参编《全国临床检验操作手册(第四版)》微生物专业、副主编及参编《临床微生物学检验标准化操作(ISO15189认可指导书)》等多本专著。现为《检验医学》杂志编委。上海检验分会微生物学组副组长,华山医院集团微生物检验联盟负责人。

Liang Chen
Liang Chen,现为美国Hackensack Meridian(哈肯萨克默里迪恩)医学院副教授,Hackensack-Meridian Health(哈肯萨克默里迪恩)探索与创新中心(HMH-CDI) 研究员。此前为美国新泽西Rutgers大学新泽西医学院医学系和公共卫生研究所助理教授。华中科技大学同济医学院本科、硕士,复旦大学博士,瑞典UMEA大学访问学者。曾兼任BMC Infectious Disease副主编及Frontier microbiology客座编辑,是Lancet Infectious Disease, Lancet Microbe, Clinical Microbiology Reviews,Nature Communications等三十余门杂志审稿人,英国医学研究理事会(MRC)课题评审人。发表相关科研论文、综述和专著等超过220篇。为HMH-CDI多项细菌基因组学研究工作的首席科学家。

余方友
上海市肺科医院(同济大学附属肺科医院)检验科主任、医学博士、教授/主任技师、博士研究生导师。先后主持课题19项,其中国家自然科学基金面上项目7项。以通讯作者或第一作者发表论文180余篇,其中SCI收录论文100余篇。获中华医学科技奖一等奖和浙江省科学技术奖一等奖各1次;为浙江省新世纪151人才工程第一层次人才、浙江省卫生高层次创新人才等。中国防痨协会结核病基础分会副主任委员、中国防痨协会人兽共患结核病分会副主任委员、中国医促会临床微生物学与感染分会常委等。
END
作者|周迎 (上海市肺科医院)
审校|蒋晓飞(复旦大学附属华山医院);Liang Chen(美国Hackensack Meridian医学院);余方友 (上海市肺科医院)

