2023-04-14 11:56
作者 周沛瑶

京港感染论坛
多学科合作,构建诊断管理体系
伤寒沙门菌(S.enterica serovar Typhimurium,S.Tm)可造成肠道急性传染病,但也有部分个体感染后成为无症状的细菌携带者,并不断从粪便中排出沙门菌,成为“超级传播者”。然而,在超级传播者的胃肠道中沙门菌与宿主的相互作用的分子机制尚不完全清楚。美国斯坦福大学医学院研究人员近日在Cell Host and Microbe发表了一篇文章,从代谢组学的角度着手,发现了L-阿拉伯糖是沙门菌在超级传播者胃肠道中播散的关键驱动因素,并进一步揭示了沙门菌利用饮食来源中的L-阿拉伯糖的分子机制,从而为控制沙门菌传播提供了新的视角。
该研究发表在《Cell Host Microbe》(JCR分区1区,2023年影响因子31.316),标题为《Salmonella-liberated dietary L-arabinose promotes expansion in superspreaders》,斯坦福大学医学院的Sarah J Ruddle为该论文的第一作者,Denise M. Monack教授为该论文的通讯作者。
![]()
为了深入了解沙门菌在慢性感染小鼠远端胃肠道播散的机制,该研究首先对95只129X1/SvJ小鼠灌胃接种野生型(WT) 沙门菌菌株SL1344,并在感染后7、14和21天(DPI)对粪便中的细菌载量进行定量(图1A),约20%的小鼠排出大于108 CFUs/g细菌载量的粪便(图1B),将其定义为超级传播者。此外,测定脾脏、肝脏、肠系膜淋巴结、盲肠内容物和粪便在感染28天后的细菌载量,对超级传播者和非超级传播者进行比较,小鼠粪便中的细菌载量有所不同,但系统组织中细菌载量水平没有显著差异(图1C),这提示远端胃肠道特异性代谢产物可能影响沙门菌的播散。为了更好地了解沙门菌感染期间小鼠肠道代谢组的变化,采用超高效液相色谱-串联质谱(UHPLC/MS)测量了感染小鼠粪便中的797种代谢物的相对丰度,主成分分析(PCA)显示与低度排菌组和中度排菌组相比,超级传播者具有独特的代谢格局(图1D)。
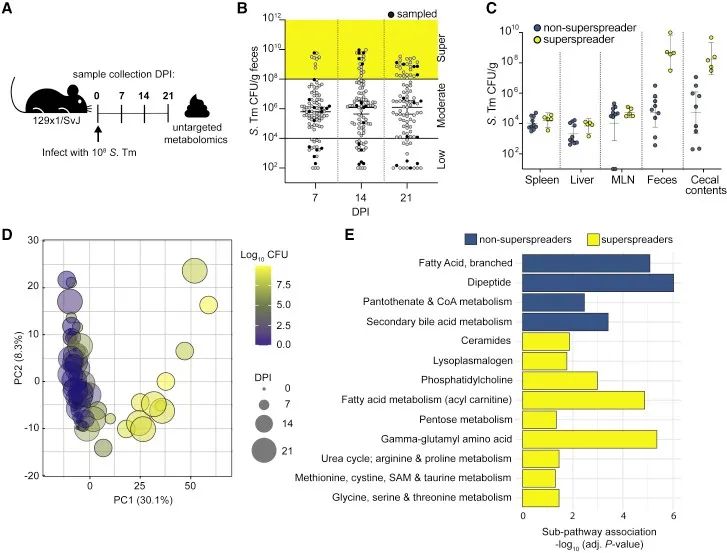
▲图1. 感染沙门菌的超级传播者具有独特的代谢格局
接下来为了探索超级传播者在独特的代谢环境中支持沙门菌播散的表型,进行了转录组分析。将小鼠灌胃接种野生型沙门菌菌株SL1344,并随时间监测粪便的细菌载量(图2A)。在感染后第7、14和21天,对小鼠实施安乐死,收集盲肠内容物和粪便进行总RNA提取。除了体内样品,还从LB平板中培养的沙门菌中提取RNA,在有氧和厌氧条件下培养到对数生长中期、对数生长期和稳定期。与体外样本相比,来自超级传播小鼠的沙门菌中几种代谢途径的基因富集。从转录组学和代谢组学中观察到了重叠的富集通路,例如,碳水化合物和羧酸盐降解途径的基因转录物在体内样本中富集,而戊糖代谢产物的变化通路在超级传播者的样本中富集(图1E)。为了更好地观察碳水化合物分解代谢变化,绘制了参与碳水化合物和羧酸盐降解途径的基因的log2倍变化图,发现L-阿拉伯糖降解通路是体内最为富集的途径(图2C)。从超级传播者体内分离出的沙门菌的L-阿拉伯糖利用操纵子(araB, araA和araC)转录本水平比体外培养样本高100倍(图2D)。与体外培养的沙门菌相比,从超级传播者的盲肠和粪便分离的沙门菌中肉碱分解代谢基因转录本(caiA, caiT)水平也有所增加(图2E)。代谢组学数据还表明,超级传播者具有独特的肉碱代谢特征,因为酰基-肉碱通路在超级传播者的体内样本中富集(图1E)。总之,这些数据表明,L-阿拉伯糖和肉碱的分解代谢可能对沙门菌在超级传播者胃肠道中的定植发挥作用。
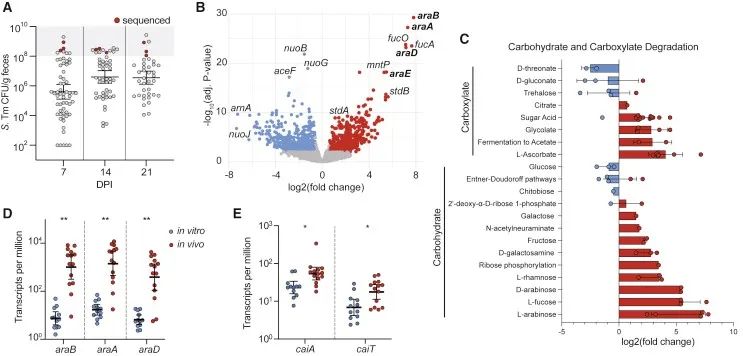
▲图2.超级传播者的粪便转录组分析揭示了沙门菌碳水化合物利用通路的变化
代谢组学和转录组学数据在超级传播者中的重叠之处使作者假设沙门菌利用L-阿拉伯糖和/或L-肉碱在远端胃肠道播散。为了探究这些途径的重要性,在小鼠的饮用水中添加1%的外源性L-阿拉伯糖或1%的L-肉碱,并在整个感染过程中让小鼠一直饮用处理过的水。结果发现,添加了外源性L-阿拉伯糖后,沙门菌在小鼠的胃肠道中迅速增殖,小鼠的粪便细菌载量在感染第三天时比对照小鼠高100倍(图3A)。相反,在整个感染过程中,给予外源性L-肉碱的小鼠与给予对照(标准)水的小鼠相比,排出粪便的细菌载量水平相等(图3B)。为了确定外源性L-阿拉伯糖是否提供了适合沙门菌增殖的炎症环境,在未感染和感染沙门菌小鼠的粪便中分析了存在或不存在外源性L-阿拉伯糖时炎症标志物脂质素-2和促炎细胞因子mRNA水平,均无明显差异。故排除外源性L-阿拉伯糖引起的间接炎症,而假定阿拉伯糖是胃肠道中沙门菌的重要碳源。
为了检测L-阿拉伯糖利用通路或肉碱降解途径是否赋予沙门菌在胃肠道中的适应优势,将沙门菌野生株和突变体等量混合后感染小鼠,并在整个感染过程的多个时间点计算竞争指数(CI)。对小鼠口服接种沙门菌野生株和L-阿拉伯糖分解代谢突变株△araBAD::KanR(沙门菌araBAD)或肉碱分解代谢突变株△caiTABCD::KanR (沙门菌cai)的等量混合物。作为阳性对照,对小鼠口服接种沙门菌野生株和缺乏三型分泌系统(T3SS)关键成分的菌株△orgA△ssaV::KanR(沙门菌orgAssaV)的等量混合物,T3SS关键成分的缺失可导致沙门菌对常规小鼠的定植作用减弱。结果表明,在感染后14天时,正如预期的那样,沙门菌野生株比沙门菌orgAssaV更具竞争优势。而沙门菌野生株和沙门菌cai生长几乎一致,沙门菌araBAD菌株与沙门菌野生株相比处于竞争劣势,适应度缺陷甚至高于对照T3SS缺陷菌株(图3C)。总的来说,实验结果表明L-阿拉伯糖代谢在胃肠道中为沙门菌提供了竞争优势。
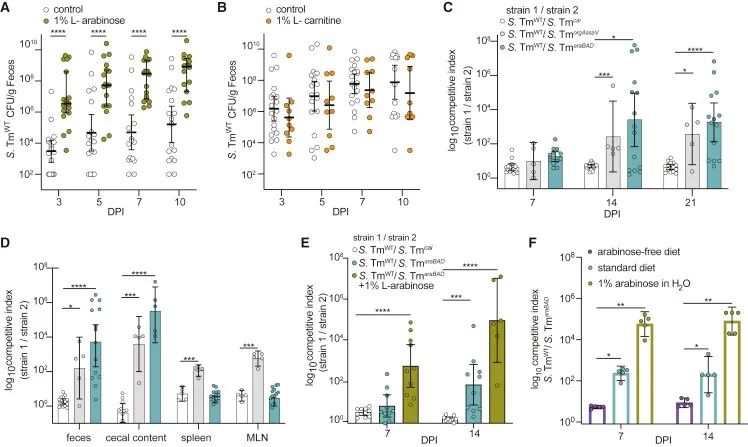
▲图3. L-阿拉伯糖的利用使沙门菌在体内具有竞争优势
为了验证沙门菌是否具有从植物多糖中释放游离L-阿拉伯糖以供自身在体内使用的能力,首先使用NCBI数据库进行了核苷酸序列BLAST搜索,以确定沙门菌中潜在的阿拉伯糖释放酶,结果发现许多肠道沙门菌基因组编码一个与已知的α-N-阿拉伯呋喃糖酶具有高度同源序列的未知基因。为了检测这个假定的阿拉伯呋喃糖苷酶的功能是否有助于沙门菌在胃肠道的定植,设计了一个缺乏该基因(STM0148)的菌株△0148::KanR (沙门菌0148),并用于小鼠的竞争实验。结果表明,沙门菌野生株远比沙门菌0148具有竞争优势(图4C),说明这种假定的阿拉伯呋喃糖苷酶赋予了沙门菌在体内的竞争优势。为了进一步研究假定的阿拉伯糖呋喃糖苷酶在沙门菌获取和利用L-阿拉伯糖中的作用,用沙门菌野生株和沙门菌0148株以1:1的比例感染小鼠,以不含L-阿拉伯糖的多糖饮食喂养小鼠。在感染后第七天,沙门菌野生株和沙门菌0148株在缺乏L-阿拉伯糖的胃肠道中竞争水平相等,这表明当小鼠饲喂缺乏含L-阿拉伯糖的多糖饮食时,阿拉伯呋喃糖苷酶并不会赋予沙门菌竞争优势(图4D)。为了进一步探究阿拉伯呋喃糖苷酶在体内的功能,用标准饮食喂养感染后的小鼠,并给予含有1% L-阿拉伯糖的水。在这些小鼠中,沙门菌野生株和沙门菌0148株相比没有竞争优势,这表明从饮食中去除含有L-阿拉伯糖的多糖和补充游离的L-阿拉伯糖足以消除阿拉伯酶呋喃糖苷酶所赋予的竞争优势(图4D)。
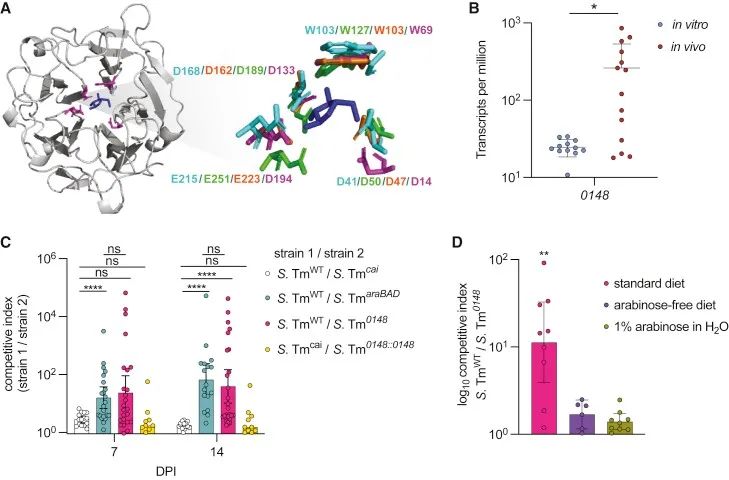
▲图4. 沙门菌利用一种功能保守的阿拉伯呋喃糖苷酶来定植于胃肠道
总之,该研究利用沙门菌感染的超级传播小鼠的代谢组学和转录组学数据来探究沙门菌在胃肠道内播散的重要分子机制。研究结果揭示了超级传播者具有独特的代谢组学格局,并揭示了沙门菌可利用饮食来源的L-阿拉伯糖作为碳源而获得竞争优势,沙门菌还可以利用α-N-阿拉伯呋喃糖苷酶,该酶从饮食多糖中释放L-阿拉伯糖,从而促进了沙门菌在超级传播者胃肠道中的播散。本研究探索了沙门菌在超级传播者胃肠道中播散的机制,为控制沙门菌传播提供了新的视角。

周沛瑶
温州医科大学与同济大学附属上海市肺科医院2022级联合培养硕士,主要研究方向为病原微生物的耐药、致病机制及分子流行病学。
END
作者|周沛瑶(上海市肺科医院)
审校|余方友(上海市肺科医院)

