2023-04-24 15:47
作者 王冰洁

京港感染论坛
多学科合作,构建诊断管理体系
皮肤微生物组通常对人体组织无害,不会引起炎症或感染。然而某些细菌定植群体可以诱导高度特异性的适应性免疫反应,其功能尚不清楚。研究人员工程改造了一种常见的皮肤定植菌——表皮葡萄球菌,使其表达黑色素瘤肿瘤抗原,并测试了它们诱导的抗肿瘤免疫反应。研究发现,改造后的表皮葡萄球菌可产生针对肿瘤的特异性T细胞,这些T细胞能够渗透并减少局部和转移性黑色素瘤的生长。当与免疫检查点抑制剂联合使用时,这些工程化的皮肤细菌能够使小鼠抵抗已形成的肿瘤。这些发现表明,来自工程菌群的免疫反应可能成为其他肿瘤的潜在疫苗。
该研究发表在《Science》(JCR分区1区,2023年影响因子63.714),标题为《Engineered skin bacteria induce antitumor T cell responses against melanoma》,美国斯坦福大学生物工程系Y Erin Chen为该论文的第一作者,Michael A Fischbach教授为该论文的通讯作者。
![]()
这项工作旨在回答两个基本问题,首先,通过探究菌群诱导的T细胞的功能特性,试图了解宿主对定植菌群反应的“目标”是什么?其次,能否通过将抗菌群免疫,特别是其抗原特异性,重新定向到感兴趣的靶点,以治疗为目的利用它的抗原特异性免疫?
为了回答上述问题,该研究通过在表皮葡萄球菌中表达肿瘤抗原,诱导出对宿主共生免疫但对肿瘤具有特异性的T细胞。然后通过进一步的体内功能测定,探究这些T细胞能否离开定植部位,浸润肿瘤并参与细胞毒性反应(图1A)。研究者开发了表皮葡萄球菌基因操作系统(图1B),针对本研究收集的多个表皮葡萄球菌分离株成功构建突变株(图1C)。作者首先尝试改造表皮葡萄球菌来表达非固有抗原。考虑到非天然肽与天然表皮葡萄球菌抗原可能存在竞争识别(图1D),选择了卵清蛋白 (OVA) 作为模型抗原,可被OVA特异性CD8 +或 CD4 + T 细胞(分别为 OT-I 或 OT-II)识别。通过构建不同的菌株,包括胞浆表达、细胞壁附着和分泌抗原三种方式,实现了OVA的表达。通过免疫印迹和电镜等方法验证了OVA的生产和定位。
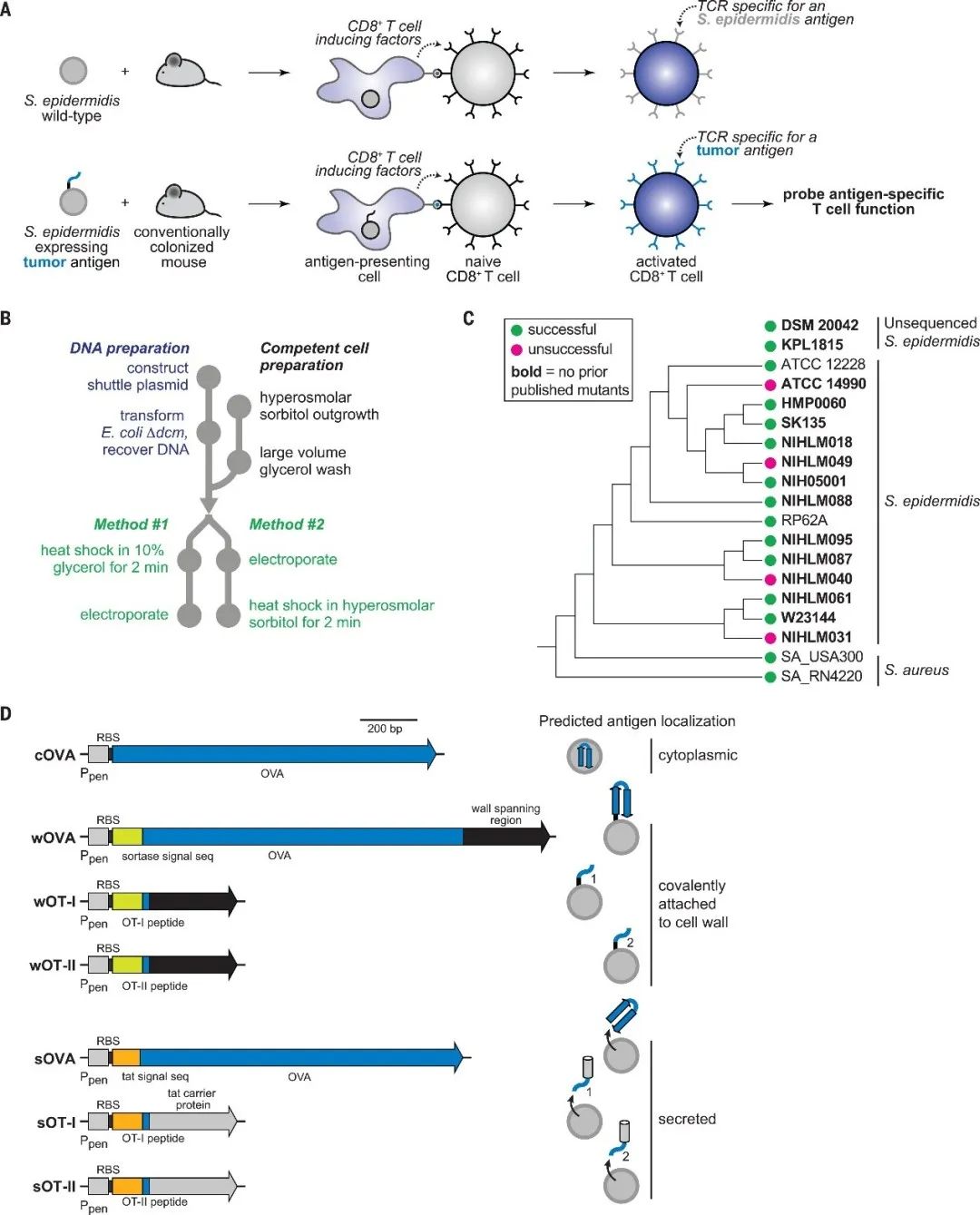
▲图1工程化改造的表皮葡萄球菌菌株表达非固有抗原
研究者通过小鼠模型证明,在定植的生理条件下,工程化改造的表皮葡萄球菌菌株在体内可以刺激非固有表位特异性T细胞反应。接下来本研究通过将工程化的表皮葡萄球菌接种于小鼠皮肤表面,成功地激活了小鼠体内的抗肿瘤活性特异性T细胞。将表达OVA的黑色素瘤细胞注射到小鼠皮下,工程化改造的表皮葡萄球菌接种组的肿瘤生长显著减缓,而未接种或接种未经过工程化的表皮葡萄球菌组则未出现此效应。另外,与无定植相比,表皮葡萄球菌定植对照没有减少肿瘤生长,因此该效应似乎是由特异性OVA-T细胞介导的,因为表皮葡萄球菌仅在OVA存在时才发挥抗肿瘤活性(图2AB)。进一步实验证明该效应需要活体定植菌参与,而非单纯地提供抗原和免疫佐剂(图2C)。
为了证明抗肿瘤作用是否由工程化改造的表皮葡萄球菌引发的OVA特异性T细胞介导,研究者首先证明了与表皮葡萄球菌定植对照相比,工程化改造的表皮葡萄球菌菌株定植导致OVA特异性CD8 + T 细胞向肿瘤中的浸润增加以及脾脏中OVA 特异性IFN-γ+ CD8 +和CD4 + T 细胞的增加(图2D)。该过程中未发现皮肤或全身炎症。通过耗尽携带肿瘤的工程化改造的表皮葡萄球菌定植小鼠的CD8 + T 细胞或所有αβ T细胞,工程化改造的表皮葡萄球菌定植的治疗效果被消除了(图2E)。通过S. epi -wOT-I 或S. epi -sOT-II模型发现OVA特异性CD4 +和 CD8 + T细胞都是必需的,附壁CD8 +抗原和CD4 +抗原是抗肿瘤活性的必要要求。总之,该研究证明,经工程化改造的表皮葡萄球菌能够诱导小鼠体内产生特异性抗肿瘤T细胞来发挥抗肿瘤作用。该作用需要CD8+和CD4+ T细胞的参与,并且该效应不会引起皮肤或系统性炎症反应。
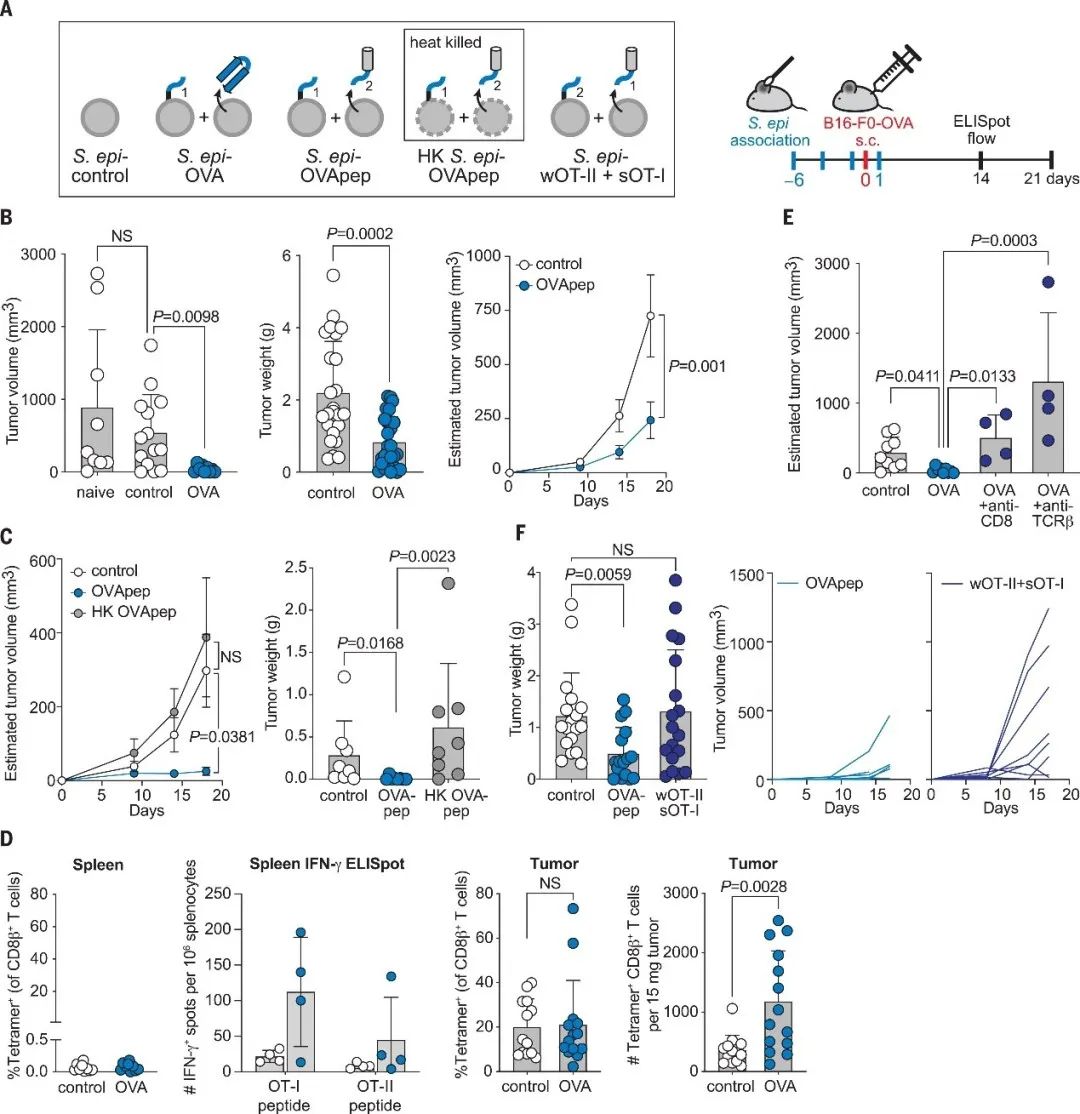
▲图2 工程化改造的表皮葡萄球菌菌株在体内减缓肿瘤进展并刺激抗原特异性T细胞
上述数据证明工程化改造的表皮葡萄球菌可以抑制皮下肿瘤的生长,尽管表皮葡萄球菌是皮肤定植菌,作者研究了表皮葡萄球菌诱导的T细胞是否可以进入其他组织发挥抗肿瘤作用。通过表达荧光素酶的转移性黑色素瘤模型证明工程化改造的表皮葡萄球菌的局部定植可减缓肺转移进展(图3AC),说明其抗肿瘤作用不限于皮肤和皮下组织,具有很高的治疗潜力。与其他方法(离体工程)相比,使用皮肤定植菌群诱导T细胞具有成本低、不易引起副作用等优点,因此具有很大的发展前景。
为了探究表皮葡萄球菌是否可以诱导针对真正的肿瘤抗原特异性T细胞,使其抗肿瘤活性与OVA特异性T细胞相当,作者改造表皮葡萄球菌,使其表达B16-F10黑色素瘤的两种含有新抗原的肽段(称为“S. epi-neoAg”)(图3B),在静脉注射B16-F10-OVA细胞前,使用S. epi-neoAg定植可有效抑制转移性肿瘤生长(图3A-C)。类似的方法也可以减缓TRAMP-C2前列腺癌模型的肿瘤进展。因此,共生菌诱导的T细胞可以针对多个宿主抗原,在不同的肿瘤中发挥作用。
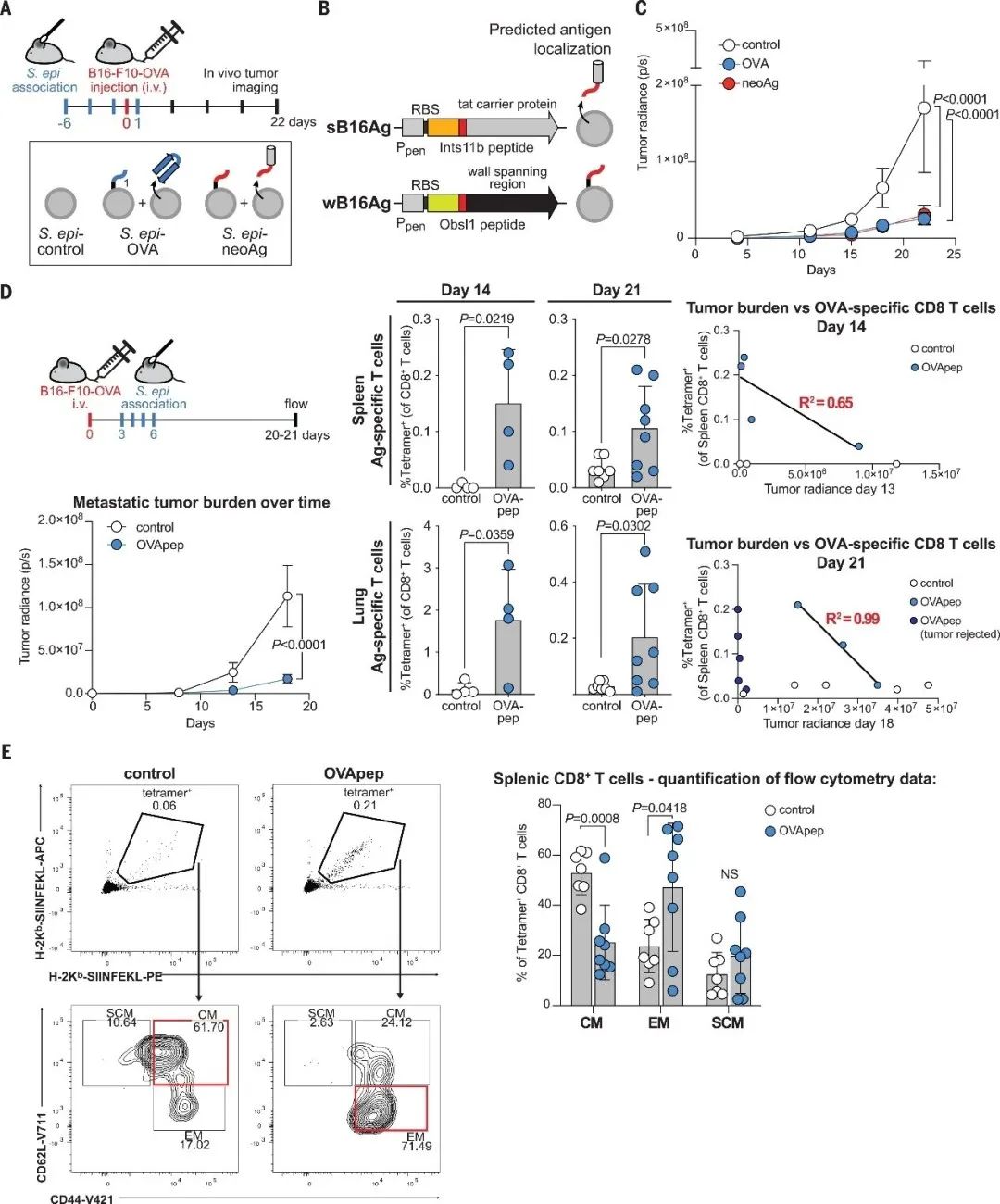
▲图3 工程化改造的表皮葡萄球菌减缓转移性肿瘤的进展
为了检测免疫检查点抑制剂能否通过缓解工程化改造的表皮葡萄球菌诱导的TIL耗尽,从而与工程化改造的表皮葡萄球菌协同发挥抗肿瘤活性,作者构建了皮下注射B16-F10-OVA肿瘤的小鼠,该模型对单用的免疫检查点抑制剂没有反应。结果显示,与表皮葡萄球菌定植菌群对照相比,免疫检查点阻滞剂联合工程化改造的表皮葡萄球菌菌导致16个肿瘤中有15个被排斥。在重复实验中,先在右侧注射肿瘤,31天后再次在左侧腹部注射肿瘤。所有小鼠左侧的肿瘤均被排斥,14只小鼠中有9只在初始肿瘤注射后2个月右侧腹部仍然没有肿瘤(图4A)。此外,在注射肿瘤前25天将小鼠接种工程化改造的表皮葡萄球菌,造成注射肿瘤时效应T细胞反应已经减弱。早期接种工程化改造的表皮葡萄球菌并结合检查点抑制剂所产生的记忆T细胞反应足以抑制肿瘤生长(图4B)。
实验结果表明,结合免疫检查点抑制剂和工程化改造的表皮葡萄球菌菌株能协同发挥抗肿瘤活性。接下来为了检测工程化改造的表皮葡萄球菌菌株联合检查点抑制剂是否可以协同治疗已形成的肿瘤,作者在B16-F10-OVA 接种后等待5天或14天,用表皮葡萄球菌对照和工程化改造的表皮葡萄球菌定植小鼠并实施免疫检查点抑制,发现肿瘤负荷减少与预免疫模型相似,大多数肿瘤消退(图4C)。因此表达肿瘤抗原的共生菌联合检查点抑制剂可产生一种有效持久的抗肿瘤反应,治疗成熟肿瘤。
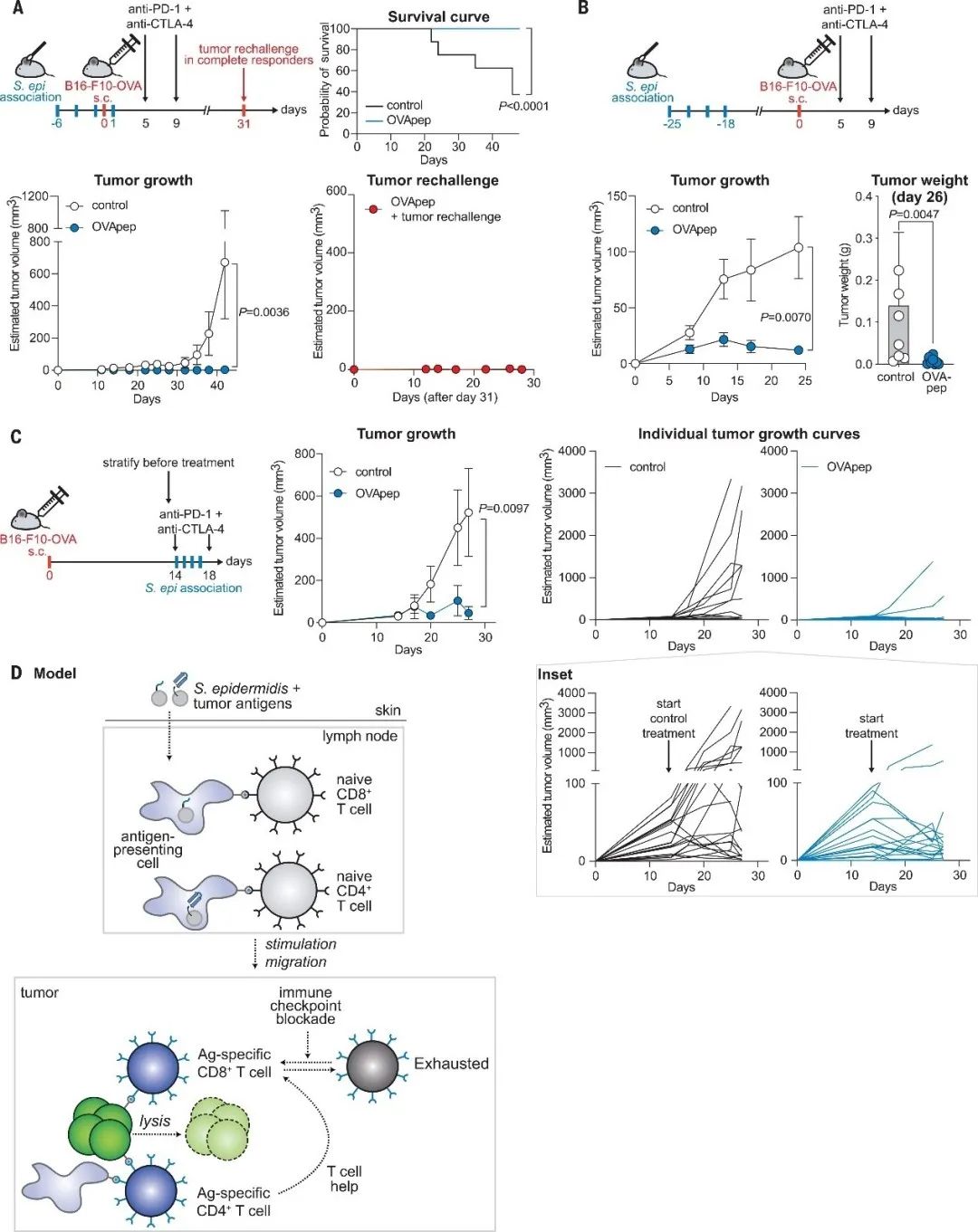
▲图4 工程化改造的表皮葡萄球菌菌株与免疫检查点抑制剂协同作用
总之,这项研究对表皮葡萄球菌株进行工程改造,使其表达模型抗原和肿瘤特异性新抗原,定植小鼠后可刺激产生肿瘤特异性CD4+和CD8+ T免疫细胞。这些免疫细胞可迁移到远端皮肤和肺部,并展现出强大的抗肿瘤活性。必须是活的表皮葡萄球菌才能引起免疫反应,这表明该过程需要活跃的菌群定植。菌群诱导的T细胞与免疫检查点抑制剂具有协同作用。对侵袭性B16-F10黑色素瘤,即使在肿瘤形成后开始治疗,也有显著效果。因此,共生菌导向的免疫反应可以在组织稳态外发挥作用,而工程定植菌群是产生针对靶标的抗原特异性T细胞的简单而强大的手段。

王冰洁
同济大学附属上海市肺科医院2020级博士研究生,导师为余方友教授,主要研究方向为病原微生物的耐药、致病机制及分子流行病学。
END
作者|王冰洁(上海市肺科医院)
审校|余方友(上海市肺科医院)

