2023-06-07 17:20
作者 何方婷

京港感染论坛
多学科合作,构建诊断管理体系
产碳青霉烯酶肠杆菌(Carbapenemase-producing Enterobacterales,CPE)在医院环境中迅速传播。无症状CPE肠道定植可能与生态失调和肠-肺轴改变有关,这可能影响肺部感染的结局。法国里尔大学Rémi Le Guern等研究人员近日在《Nature Communications》杂志上发表了一篇研究论文,研究团队利用雄性C57BL/6JRj小鼠,发现了由CPE定植导致的特定肠道生态失调,并探讨了CPE定植后铜绿假单胞菌肺部感染的免疫反应和转归。
该文章于2023年1月发表在《Nature Communications》,标题为《Gut colonisation with multidrug-resistant Klebsiella pneumoniae worsens Pseudomonas aeruginosa lung infection》,法国里尔大学Rémi Le Guern为第一作者和通讯作者。
原文链接:
https://www.nature.com/articles/s41467-022-35767-4
![]()
▼ 1. 前言
铜绿假单胞菌是导致住院病人,特别是重症监护病房病人严重和致命肺炎的罪魁祸首。铜绿假单胞菌所引起肺炎的结局不仅取决于其对抗菌药物的敏感性/耐药性,还取决于病原体的毒力和宿主的免疫反应。近年来,肠道微生物组及其改变(生态失调)已成为改变肺部感染免疫应答的组成部分,这种模式被称为肠-肺轴。
在小鼠急性细菌性肺部感染模型中进行的几项研究表明,感染的结局是由肺部免疫反应决定的,而肺部免疫反应可能被肠道生态失调所改变。事实上,广谱抗生素引起的肠道生态失调通过改变肺部IgA反应使铜绿假单胞菌感染的结局恶化。同样,针对肺炎链球菌感染,抗生素诱导的生态失调会导致肺巨噬细胞功能受损和预后不良。本研究团队还发现抗生素诱导的肠道生态失调通过广泛抑制肺细胞免疫反应而加重铜绿假单胞菌肺部感染。
除了抗生素,多重耐药菌的肠道定植本身也与肠道生态失调有关。值得注意的是,产碳青霉烯酶肠杆菌(Carbapenemase-producing Enterobacterales,CPE)的肠道定植与重症监护病房患者死亡率增加以及住院时间延长相关。此外,无论抗菌素耐药性如何,肠道内肠杆菌丰度的增加与普通人群中更高的全因死亡率相关,呼吸系统疾病造成的死亡也有所增加。因此,CPE定植不仅是后续抗生素耐药感染的来源,还可能影响肺部感染的结局。
研究人员发现,在本研究的小鼠模型中,CPE肠道定植改变了对铜绿假单胞菌感染的肺部免疫反应,并通过不同于抗生素诱导的生态失调来调节肠-肺轴,从而恶化了感染结局。
▼ 2. 抗生素和CPE暴露相关的肠道菌群改变
根据先前报道,为维持稳定的CPE肠道定植,本研究中抗生素给药(克林霉素)持续到了第14天(图1b)。在仅暴露于CPE而未使用抗生素的小鼠中,CPE负荷是短暂的,且在暴露5天后下降至粪便检测限以下。同时暴露于CPE和克林霉素的小鼠既没有感染症状,也没有结肠炎的组织学特征,因此,这是CPE定植而不是感染(图1c)。
该研究描述了与抗生素(克林霉素)或CPE暴露相关的肠道菌群改变。对照组小鼠和仅暴露于CPE(无抗生素处理)的小鼠在CPE暴露14天后,肠道微生物组的组成和α多样性相似(图1d, e)。CPE定植(克林霉素和CPE共同处理)小鼠表现出最低的α多样性指数和菌群组成的重要变化。Muribaculaceae(以前称为S24-7)属于拟杆菌目,占对照组小鼠菌群丰度的35.5%,单独暴露于CPE后占25.9%,给予克林霉素干预后占17.4%,在CPE定植(克林霉素和CPE共同处理)的情况下占0.03%。
与单独暴露于克林霉素的小鼠相比,CPE定植小鼠肠道中的Muribaculaceae显著减少(p < 0.0001)。相反,与对照组相比,CPE定植小鼠中Akkermansiaceae的相对丰度增加(p < 0.0001),但与暴露于克林霉素的小鼠相比,该菌丰度差异没有统计学意义(p = 0.56)。CPE的肠道定植与特定的生态失调有关,与单独暴露克林霉素相关的肠道生态失调相比,其特征是Muribaculaceae,Rikenellaceae和Lachnospiraceae_NK4A136_group持续显著减少。与对照组相比,暴露于克林霉素或CPE定植的小鼠肠杆菌科的相对丰度增加。在属水平上,与对照组相比,暴露于克林霉素的小鼠肠道中埃希菌/志贺氏菌丰度增加,而CPE定植的小鼠肠道中克雷伯菌和埃希菌/志贺氏菌均增加。通过常规微生物培养,与对照组(3.7 log CFU/g粪便)相比,暴露于克林霉素的小鼠(8.7 log CFU/g粪便)或CPE定植的小鼠(8.2 log CFU/g粪便)肠道中大肠杆菌水平增加;而肺炎克雷伯菌丰度仅在CPE定植的小鼠中升高(8.9 log CFU/g粪便)。
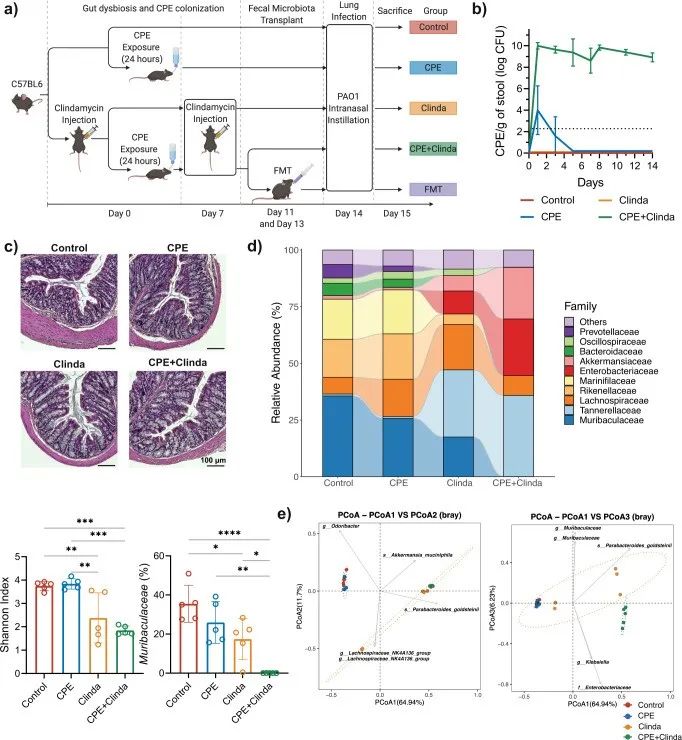
▲图1. CPE无症状肠道定植导致特定的肠道生态失调
▼ 3. CPE肠道定植与随后铜绿假单胞菌肺部感染的不良结局相关
为了评估抗生素或CPE定植对宿主防御抵抗肺部感染的影响,在第14天通过鼻内滴注铜绿假单胞菌感染小鼠,并在18小时后进行评估。通过疾病严重程度评分、肺泡毛细血管通透性(肺损伤指数)(图2a)和肺组织学评分(图2d),发现在CPE定植小鼠中,铜绿假单胞菌引起的肺部感染加重,而支气管肺泡灌洗液(BAL)中的细胞数量没有统计学差异(图 2c)。组织学分析显示,CPE定植促进支气管周围和肺泡区域的炎症浸润(图2e)。此外,与对照组相比,CPE定植明显增加了出血面积、肺泡壁厚度和支气管上皮病变;克林霉素处理也主要是通过增加炎症细胞募集和肺泡壁增厚而使组织学评分升高,尽管其强度低于CPE定植小鼠。此外,各组小鼠肺部的菌量无显著差异(图2b)。然而,CPE定植小鼠的脾脏中铜绿假单胞菌的感染增加。仅暴露于CPE(无抗生素处理)或仅暴露于抗生素(无CPE处理)的小鼠肺部感染严重程度无显著差异。
为了明确更严重的肺部感染结局不是由所使用的CPE菌株(产生NDM碳青霉烯酶的肺炎克雷伯菌)特定引起的,研究人员用另外两株细菌(产OXA-48或KPC碳青霉烯酶的克雷伯菌)重现了这些结果。CPE稳定的肠道定植维持到第14天。在产OXA-48或KPC碳青霉烯酶的肺炎克雷伯菌定植的小鼠中,疾病严重程度评分、肺泡毛细血管通透性(肺损伤指数)和铜绿假单胞菌在脾脏中的播散增加。在CPE定植而菌量无任何增加的小鼠中,铜绿假单胞菌肺部感染的结局更差,这提示宿主反应可能是细菌传播增加的原因。
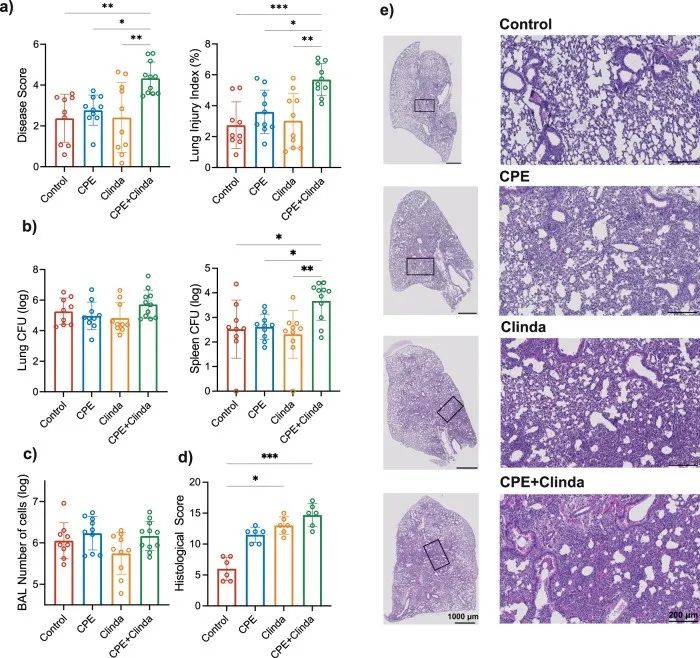
▲图2. CPE定植肠道后加重铜绿假单胞菌的肺部感染
▼ 4. CPE肠道定植后铜绿假单胞菌感染肺部肺泡巨噬细胞(AM)和树突状细胞(DC)减少
研究人员分别评估了抗生素暴露(克林霉素)、单独暴露于CPE或CPE定植(克林霉素和CPE共同处理)对随后铜绿假单胞菌引起肺部感染时肺和脾脏免疫细胞反应的影响。与未感染小鼠(鼻内注入无菌磷酸盐缓冲盐水(PBS))相比,铜绿假单胞菌感染显著增加了1型和2型常规树突状细胞(cDC1,cDC2)和自然杀伤T细胞(NKT)的数量。全肺组织的细胞群分析显示,只有在CPE预先定植肠道后,AM和cDC2才会减少(图3a)。CPE小鼠AM中II类MHC分子的表达水平与对照组小鼠相比也有所下降,但DC中没有。中性粒细胞数量无显著差异。在脾脏中,CPE预先定植使巨噬细胞数量减少,而其他主要的抗原呈递细胞和淋巴细胞群没有明显改变。与接受克林霉素处理的小鼠相比,CPE定植小鼠BAL中的TNF-α浓度显著增加(958.2±265.5 vs 514.2±512.4 pg/ml,p = 0.048)(图3b)。
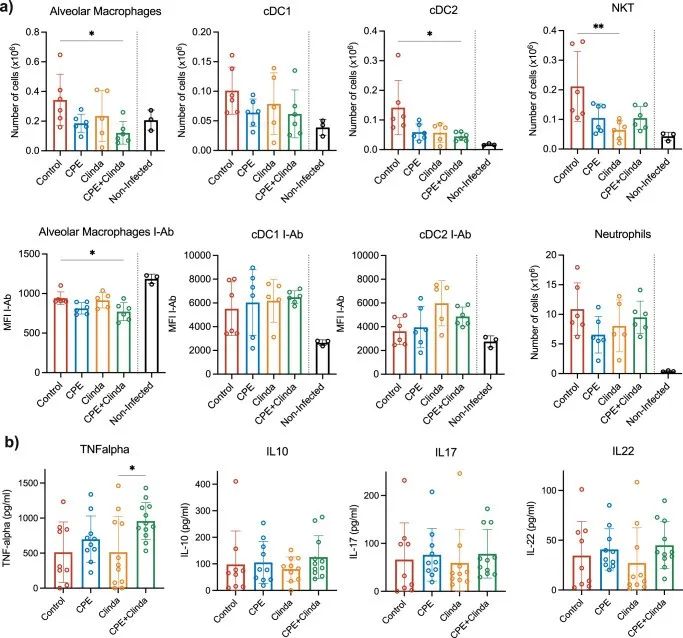
▲图3. CPE定植肠道后,铜绿假单胞菌的肺部感染与AM和cDC的募集减少有关
▼ 5. 粪菌移植可改善既往 CPE 肠道定植后的铜绿假单胞菌肺部感染结局
CPE定植小鼠的粪便菌群移植(FMT)限制了铜绿假单胞菌肺部感染的结局,并恢复到了与感染对照小鼠相似的状态(图4a-c)。FMT处理的CPE定植小鼠与未经FMT处理的CPE定植小鼠相比,疾病严重程度评分、肺泡毛细血管通透性、BAL细胞数量和死亡率均显著降低。此外,与CPE定植小鼠相比,FMT处理还降低了组织学评分。FMT在一定程度上降低了CPE定植对出血区域、肺泡壁增厚和组织病变的影响,而两组的炎症浸润程度相似。生存分析显示,与CPE定植小鼠相比,FMT处理后的小鼠死亡率降低(60.0% vs 93.3%,p = 0.03)(图4d)。这些结果表明,CPE定植诱导的生态失调与观察到的铜绿假单胞菌肺部感染恶化的表型有关。
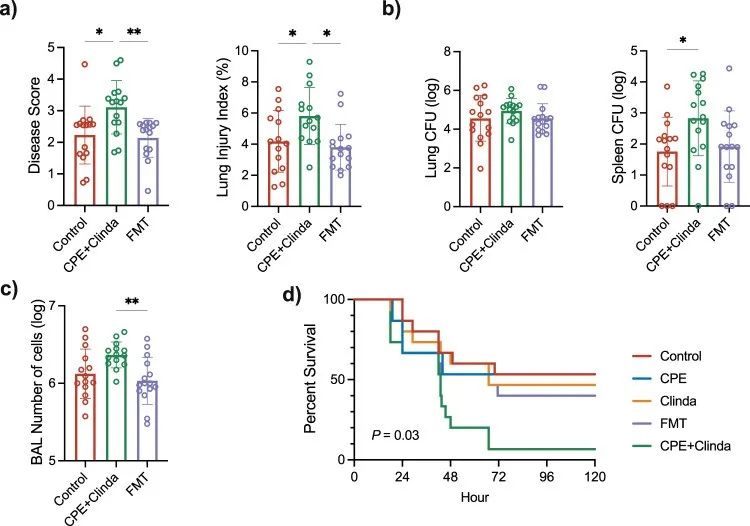
▲图4. CPE定植小鼠的FMT可改善铜绿假单胞菌肺部感染的预后
本研究通过评估免疫反应来确定FMT是否可以恢复宿主对铜绿假单胞菌感染的免疫应答。FMT处理后AM、cDC1和cDC2的数量部分恢复,而它们的活化水平保持不变(图5a)。中性粒细胞无显著差异。在脾脏中,FMT并未明显改变抗原递呈细胞,但可诱导一定程度的细胞活化,如增加Ⅱ类MHC分子表达的表达。此外,与CPE定植小鼠相比,FMT显著降低BAL中TNF -α的浓度(335.2±257.6 vs 720.0±172.1 pg / ml,p < 0.001);与对照组小鼠相比,FMT可明显降低IL-22浓度(31.6±29.3 vs 52.8±32.3 pg / ml,p = 0.04)(图5b)。
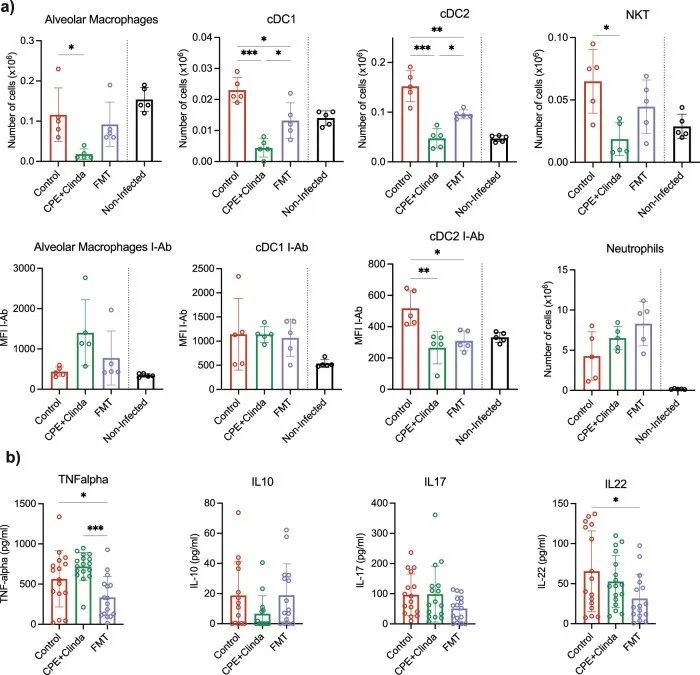
▲图5. CPE定植小鼠的FMT部分恢复铜绿假单胞菌肺部感染后的肺抗原呈递细胞
▼ 6. 粪菌移植部分恢复肠道菌群组成,但不降低粪便中CPE定植水平
本研究通过测定粪便中的CPE菌量来评价FMT是否可对肠道中的CPE“去定植化”。FMT没有降低粪便中CPE浓度(图6a)。CPE定植14天(第一次FMT后第3天)的小鼠粪便平均CPE菌量为8.0±0.7 log CFU/g,FMT后的粪便平均CPE菌量为8.1±0.6 log CFU/g (p = 0.54)。然而,如16s rRNA扩增分析所示(图6b),FMT改变了肠道菌群组成,增加了α-多样性。FMT与Muribaculaceae相对丰度的部分恢复有关, 在CPE定植小鼠中占3.7%,FMT处理后占20.9%(p < 0.001)。相反,与CPE定植小鼠相比,FMT处理后Akkermansiaceae的相对丰度有降低趋势(CPE为12.8% vs FMT为4.8%),但差异无统计学意义(p = 0.44)。β-多样性(Bray-Curtis差异)显示FMT处理后菌群部分恢复(图6c)。总体而言,FMT部分恢复了CPE定植小鼠肠道菌群的多样性和组成,而没有降低CPE载量(即没有“去定植化”)。
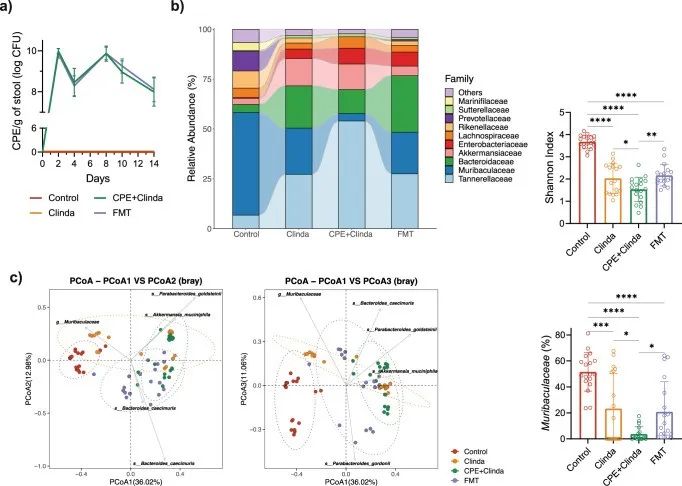
▲图6. FMT在不降低粪便中CPE定植水平的情况下部分恢复肠道菌群组成
▼ 7. 单独补充Muribaculum intestinal不能引起稳定定植
考虑到CPE定植小鼠体内的Muribaculaceae菌丰度降低,研究人员评估了在感染前三天每天灌胃补充Muribaculum intestinal DSM 28989的效果。补充M. intestinal并没有显著改变与CPE定植相关的严重肺部感染结局。与FMT处理后的数据相比(图6),第14天通过qPCR测定Muribaculum sp. 的相对丰度,在对照组为7.9%,在CPE定植小鼠中为0.009%,在补充M. intestinal的小鼠中为0.006%,说明M. intestinal的补充并未引起Muribaculum稳定的肠道定植。
▼ 8. 肠道短链脂肪酸(SCFA)浓度在CPE肠道定植中降低,口服SCFA可改善肺部感染
由于FMT处理后Muribaculaceae的丰度增加,并且已有研究表明与SCFA的产生有关,因此本研究检测了盲肠中的SCFA浓度。与仅暴露于克林霉素的小鼠相比,CPE定植小鼠的盲肠中的乙酸盐、丙酸盐、丁酸盐和总SCFA浓度降低(总SCFA浓度分别为20.6±3.3 µmol/g vs 39.0±16.3 µmol/g, p = 0.049)(图7a)。尽管FMT处理后总SCFA浓度有升高趋势,但无显著差异(CPE定植小鼠的总SCFA浓度为20.6±3.3 µmol/g vs FMT处理后为38.3±12.0 µmol/g,p = 0.063)。然而,FMT显著增加了乙酸和丙酸的水平(图7a)。
研究人员通过在感染前7天补充含有SCFA(醋酸盐、丙酸盐和丁酸盐)的饮用水,探讨了SCFA对CPE定植小鼠的潜在治疗作用。补充SCFA显著增加了盲肠腔中总SCFA和醋酸盐的浓度,但丙酸盐和丁酸盐的水平没有显著差异。在第14天,添加SCFA并没有显著降低CPE定植小鼠粪便中的CPE浓度(8.9±0.3 log CFU/g粪便vs 9.1±0.6 log CFU/g粪便p = 0.27)。
补充SCFA后,感染铜绿假单胞菌的小鼠的疾病严重程度和肺泡毛细血管通透性降低(图7b),而细菌载量和BAL中细胞数量没有改变(图7c, d)。生存分析显示,补充SCFA后死亡率较低(图7e)(p = 0.01)。此外,本研究用流式细胞术分析了SCFA处理小鼠的肺免疫谱,发现SCFA对肺脏和脾脏中免疫细胞的募集作用有限。
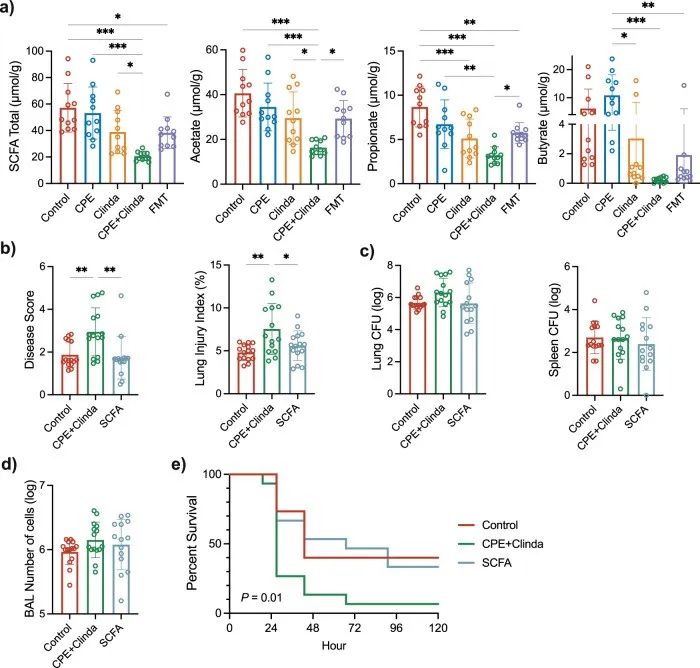
▲图7. CPE定植的情况下通过补充SCFA可以改善肺部感染的结局
▼ 9. 结语
总体而言,通过对肠道菌群的特定改变,CPE的无症状定植与随后铜绿假单胞菌肺部感染的严重程度、死亡率增加有关。本研究阐述了无症状肠道CPE定植对随后肺部感染结局的有害影响。FMT的作用提示,定植诱导的肠道生态失调(而不是CPE的存在)对肺部感染反应产生了有害后果。在持续肠道生态失调的情况下,补充SCFA或采用其他导致SCFA产生的治疗干预措施,可能有助于降低肺部感染的严重程度。

何方婷
四川大学医学博士,目前任职于成都市第二人民医院医学检验科。
END
作者|何方婷(成都市第二人民医院)
审校|喻 华(四川省医学科学院·四川省人民医院)

