2023-06-29 17:20
作者 严小甜

京港感染论坛
多学科合作,构建诊断管理体系
![]()
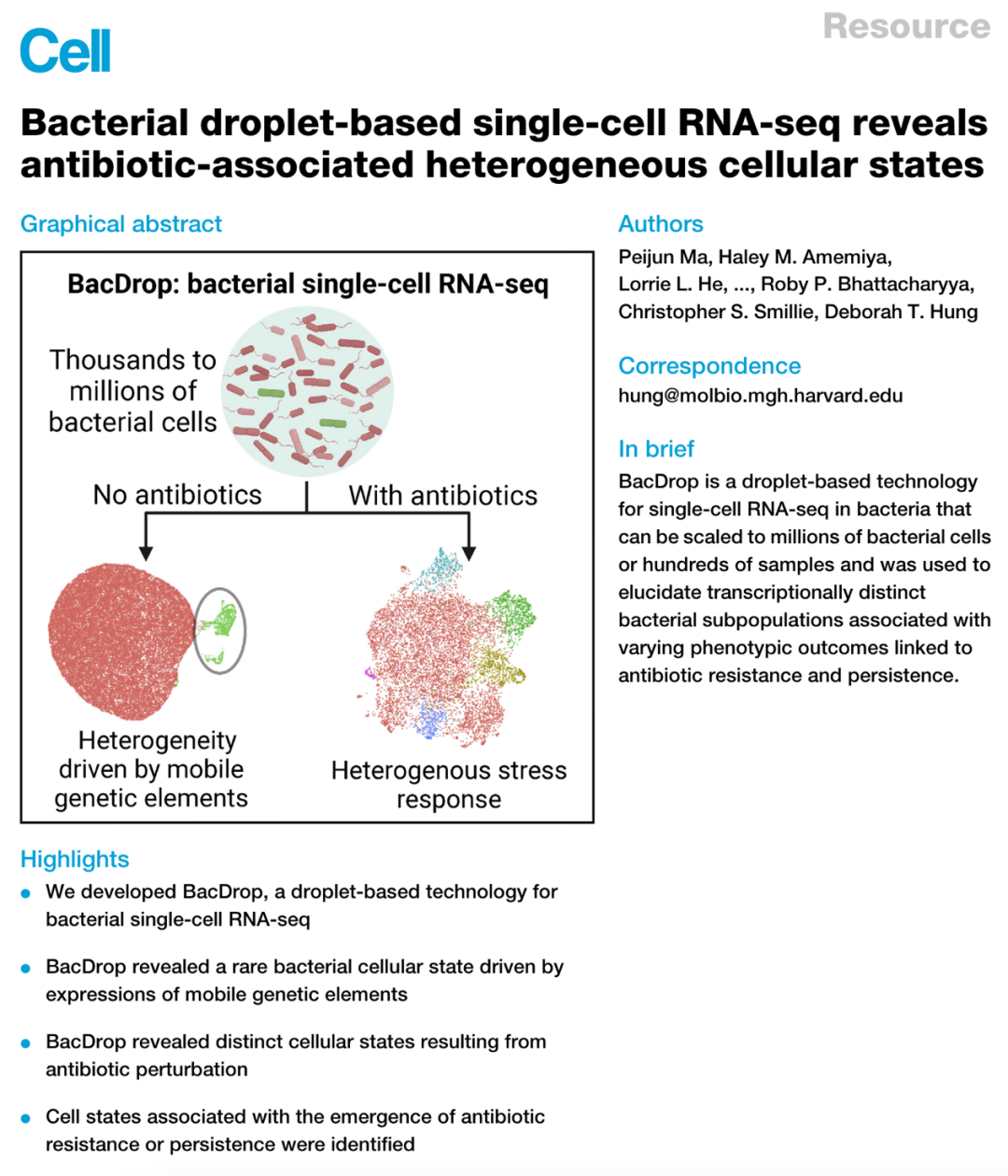
单细胞RNA测序技术(scRNA-seq)在细菌检测中的应用较为有限,尤其在检测大规模的细菌群体以及描述细菌群体内的异质性时存在一定局限性,探索新的细菌单细胞测序方法对于研究微生物系统至关重要。近日,美国麻省理工学院-哈佛大学的博德研究所的研究者们在《Cell》期刊发表了一项研究,报道了一种高度可扩展的细菌单细胞RNA-seq技术——BacDrop,该技术可对数百万个细菌细胞或数百个样本进行大规模分析,捕获bulk RNA-seq技术无法检测到的细菌细胞状态。作者提出BacDrop可在转录层面揭示单一菌株的群落内异质性,并鉴定出群落中具有抗生素抗性和持留性表型的细菌亚群,在微生物组研究中具有良好的应用前景。
该文章于2023年2月16日发表在《Cell》杂志,标题为《Bacterial droplet-based single-cell RNA-seq reveals antibiotic-associated heterogeneous cellular states》,美国麻省理工学院-哈佛大学的博德研究所的Peijun Ma为第一作者,Deborah T Hung教授为通讯作者。
原文链接
https://doi.org/10.1016/j.cell.2023.01.002
▼ 1. BacDrop:一种基于细菌液滴的大规模平行scRNA-seq技术
研究者们借助10x基因组学平台开发了基于液滴微流体技术的scRNA-seq平台——BacDrop,具有更高的规模,并能更好的裂解细菌细胞壁的同时保留RNA的完整性(图1A)。每个液滴中可加载3-6个细胞,并借助“板状条形码”(plate barcoding)和“液滴条形码” (droplet barcoding)组合用于唯一识别细胞,具体技术原理如图1B所示。
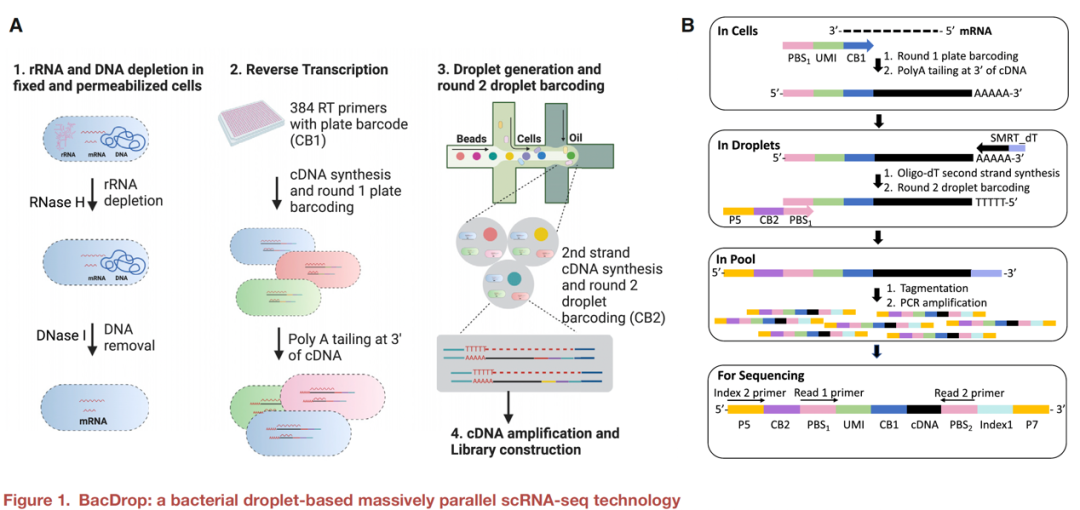
▼ 2. BacDrop的技术性能验证
该研究首先证实了rRNA去除和细胞固定不影响样本mRNA的提取(图2A-C),且BacDrop产生的转录图谱与传统批量RNA-seq方法产生的转录谱高度一致(图2D)。此外,该技术应用的两步条形码策略可减少细胞条形码碰撞率,细胞识别性能良好(图2E)。随后,研究者们将BacDrop应用于革兰阴性的大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌及革兰阳性的屎肠球菌的检测,经条形码标记、文库构建及Seurat分析后,该技术可有效区分上述四种物种(图2F),证实BacDrop具有区分不同细菌物种的能力。
研究者们还评估了BacDrop用于区分基因表达水平不同的菌株的敏感性。他们选取了三株GFP表达水平不同的大肠埃希菌菌株,使用流式细胞术和RT-qPCR分别确认了菌株中GFP的蛋白表达水平和相关mRNA表达情况(图2G-H),继而用BacDrop量化了每个细胞中的GFP表达水平。研究发现BacDrop测量出的三株菌株GPF表达量之间存在统计学差异,与RT-qPCR结果一致(图2I)。
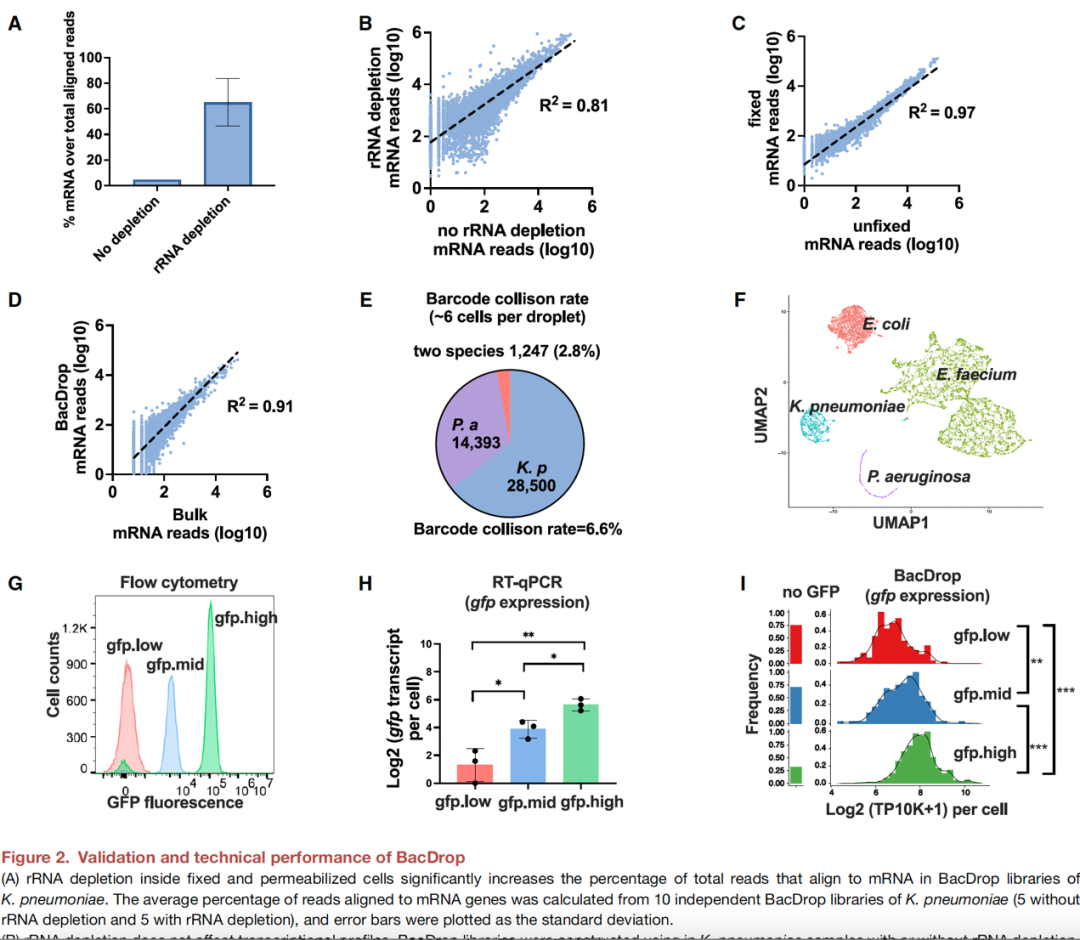
▼ 3. BacDrop对单一细菌分离株亚群的鉴别能力验证
如图3A所示,该研究将一株抗生素敏感的肺炎克雷伯菌临床分离株MGH66的培养物(OD600~0.2)分成四等份,其中一份未做处理,剩余三份分别用美罗培南、环丙沙星和庆大霉素处理,随后收集所有培养物进行BacDrop测序分析。相比于未处理组,环丙沙星诱导了参与DNA损伤应答(SOS应答)的基因如recA的表达,而庆大霉素治疗诱导了一组热休克伴侣蛋白如ibpB的表达,而美罗培南处理后观察到的转录水平改变最小(图3B)。重复实验证实BacDrop可区分异质性细胞群体,且具有较高可重复性(图3C–F)。
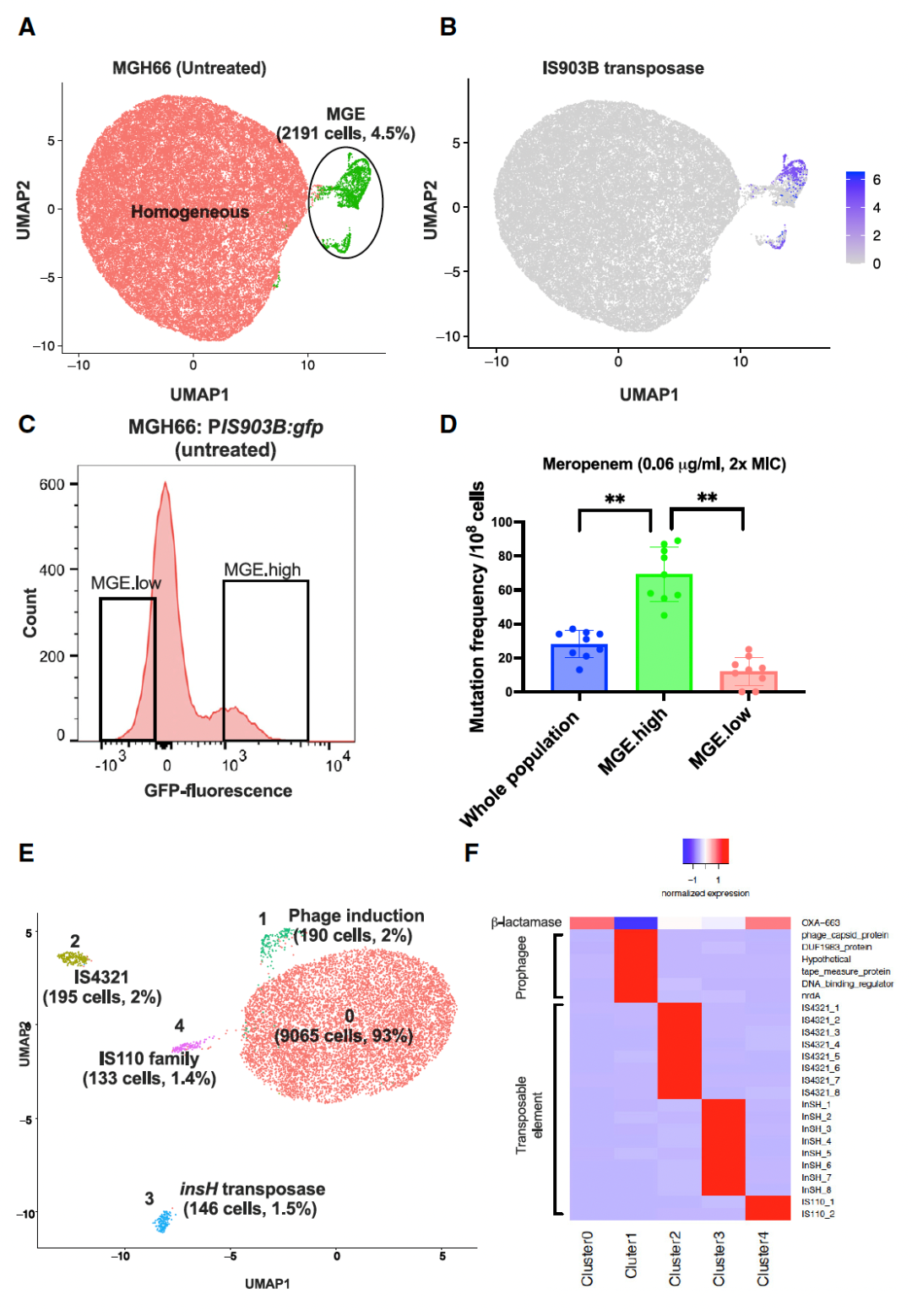
▼ 4. BacDrop揭示群体内异质性,亚群主要由可移动遗传元件(MGE)的表达驱动
该研究在单细胞水平上深入分析了未经抗生素处理的MGH66培养物,借助无监督聚类(unsupervised clustering)分析鉴别出两种主要的细胞亚群,其中包括一个由IS903B转座酶基因驱动的MGE亚群(图4A-B)。该亚群具有高表达水平的转座子基因,可能是肺炎克雷伯菌对碳青霉烯抗性频率升高的原因。
为验证这一假设,研究者们用肺炎克雷伯菌MGH66构建了一株报告菌株MGH66: PIS903B:gfp,该菌株可表达IS903B转座酶基因的启动子驱动的绿色荧光蛋白。流式细胞术证实该报告菌株中MGE的异质性表达(图4C),荧光激活细胞分选(fluorescence-activated cell sorting,FACS)实验发现MGE.high群体的突变频率至少是MGE.low群体的7倍(图4D),进一步证实了菌株的抗生素抗性可能来自该高表达MGE基因的亚群。同时,研究们者们将BacDrop应用于另一肺炎克雷伯菌临床分离株BIDMC35的研究并再次观察到MGE驱动的亚群,证明该现象并非MGH66所独有(图4E-F)。
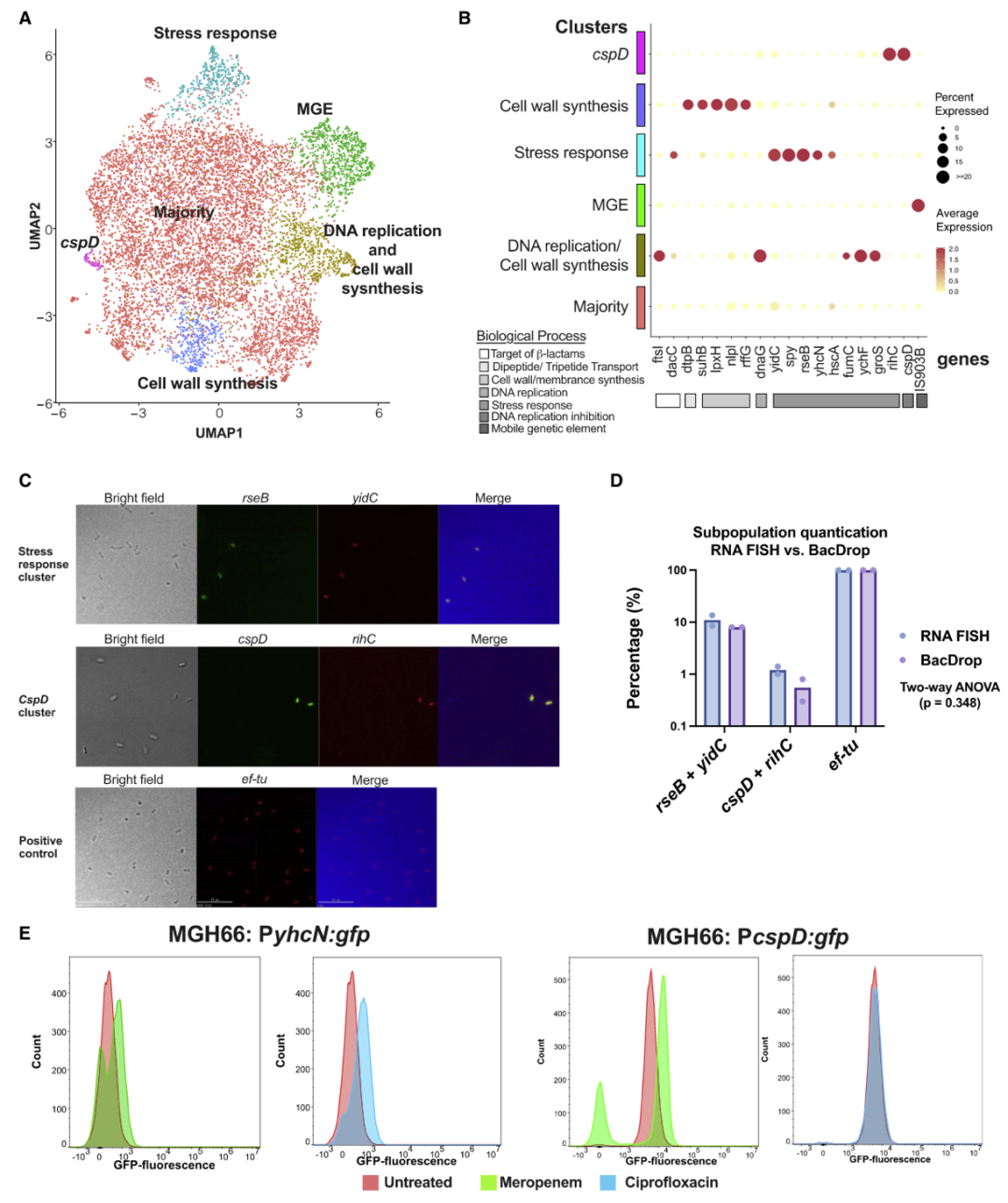
▼ 5. BacDrop揭示细菌对抗生素暴露的异质性应激反应
该研究还分析了不同抗生素暴露后的群体在单细胞水平下的异质性转录反应(图3A)。除MGE亚群外,美罗培南处理诱导了四个具有不同分子反应的相互作用亚群(图5A-B)。研究者们鉴定了每个特定亚群中高度表达的基因(图5B),并使用RNA荧光原位杂交(FISH)验证BacDrop鉴别的“应激反应”和“cspD表达”亚群的存在(图5C-D)。该研究还使用荧光细胞术量化了这两种亚群的细胞数量,并证实美罗培南可同时诱导yhcN和cspD的异质性表达,与BacDrop结果一致(图5E)。在美罗培南干扰下,该研究观察到在bulk RNA-seq结果中被掩盖的各种应激反应途径驱动的强烈的异质性反应,这可能导致细胞裂解或抗生素耐受等异质性细胞命运。
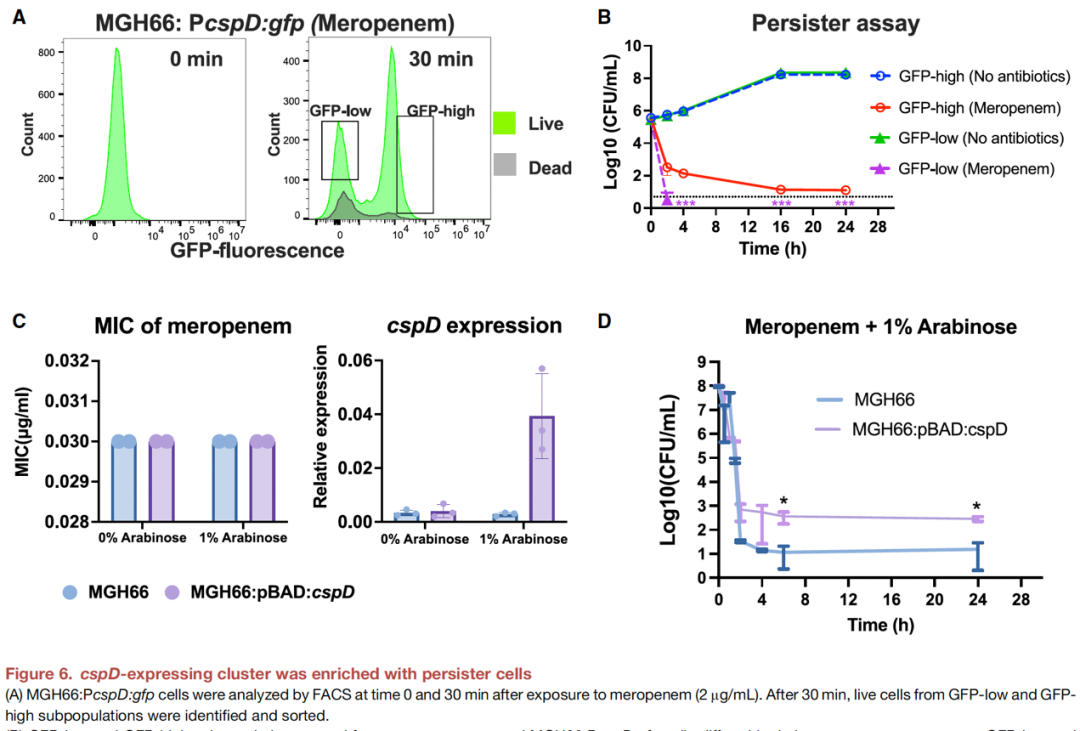
▼ 6. BacDrop检测到降低美罗培南疗效、增加持留的亚群
研究者们将MGH66:PcspD:gfp细胞暴露于2 mg/mL美罗培南0或30分钟后通过荧光激活细胞分选直接分为GFP-high和GFP-low亚群(图6A)。与GFP-low亚群相比,GFP-high亚群富集了美罗培南耐受细胞(图6B)。全基因组测序验证了这些耐受细胞未获得基因突变,但在过度表达cspD的MGH66菌株中,持留菌增加了100倍(图6C-D)。这些结果证实了cspD在肺炎克雷伯菌MGH66亚群持留性形成中的作用。
▼ 研究结论:
该文章介绍了一种高度可扩展的细菌单细胞RNA测序技术BacDrop,它克服了阻碍细菌单细胞RNA测序发展的诸多挑战,可以应用于数千到数百万革兰氏阴性菌和革兰氏阳性菌的细胞。该技术包含通用核糖体RNA去除过程,借助组合条形码可实现多重和大规模平行测序。研究者们应用BacDrop对肺炎克雷伯菌临床分离株进行了单细胞RNA测序,阐明了菌株对抗生素压力的异质性反应。在同质的未受干扰的群体中,研究发现群体内的异质性很大程度上是由促进抗生素耐药性进化的移动遗传元件的表达驱动所致。在抗生素干扰下,BacDrop鉴定出不同转录水平对应的不同表型的亚群。因此,BacDrop可捕获bulk RNA-seq无法检测到的细胞状态,这将为研究细菌应对干扰的应激反应及更大的细菌群落如微生物组的研究提供新的微生物学见解。

严小甜
浙江大学医学院,硕士研究生
END
作者|严小甜(浙江大学医学院)
审校|张 嵘(浙江大学医学院附属第二医院)

