2023-06-30 17:20
作者 王思恒

京港感染论坛
多学科合作,构建诊断管理体系
![]()
人体肠道共生菌群中最常见的有厚壁菌门、拟杆菌门、放线菌门和变形菌门等,它们在调节机体免疫反应、营养吸收、抵抗病原体定植等方面发挥重要作用。当使用抗生素时,肠道菌群组成发生变化,大多数抗生素敏感的共生菌和病原菌被清除的同时,具有抗性基因的共生菌不断富集。因此,抗生素选择可能会导致抗生素耐药基因(ARGs)在共生菌中的富集,从而使得共生菌成为ARGs的储库,这些ARGs随后可通过可移动的基因元件(MGEs)或噬菌体水平转移到病原菌中,从而使得病原菌获得抗生素耐药性。
尽管近年来,科学家已经对ARG的水平转移现象进行了相关研究。但目前为止,大多数研究仍然未能在菌株水平上验证MGE的转移,对人类肠道共生菌和病原菌之间的耐药基因水平转移的真实程度和高风险的MGE仍缺乏深入了解。

英国辛克斯顿维康信托桑格研究所微生物群-宿主互作实验室研究人员Samuel C. Forster等在Nature子刊《Nature Communications》发表一篇名为《Strain-level characterization of broad host range mobile genetic elements transferring antibiotic resistance from the human microbiome》的论文。
该论文研究了病原菌和共生菌之间的基因水平转移(HGT)的程度和规模,重点研究了ARG相关MGEs的特征,表明了这些MGEs保留了转移的能力,并可能将相关的ARG传播到更多细菌中。该研究工作建立了MGE介导的ARG在人类肠道共生菌和病原菌之间的传播网络,提出广泛宿主范围的MGE应作为潜在ARG传播的管理目标。
原文链接
https://www.nature.com/articles/s41467-022-29096-9
▼ 1. MGEs广泛存在于共生菌和致病菌中
为了了解人类胃肠道病原菌和共生菌之间携带ARGs的MGEs水平转移的程度,研究人员首先比较了1354个肠道共生菌基因组(530个菌种)和45403个肠道病原菌基因组(来自12个代表性肠道病原菌,包括产酸克雷伯氏菌、肺炎克雷伯菌、大肠埃希菌、肠道沙门氏菌、宋内志贺杆菌、福氏志贺菌、大肠弯曲杆菌、空肠弯曲菌、粪肠球菌、屎肠球菌、艰难梭菌和产气荚膜梭菌),发现了389,541个可能的水平转移基因(图1)。
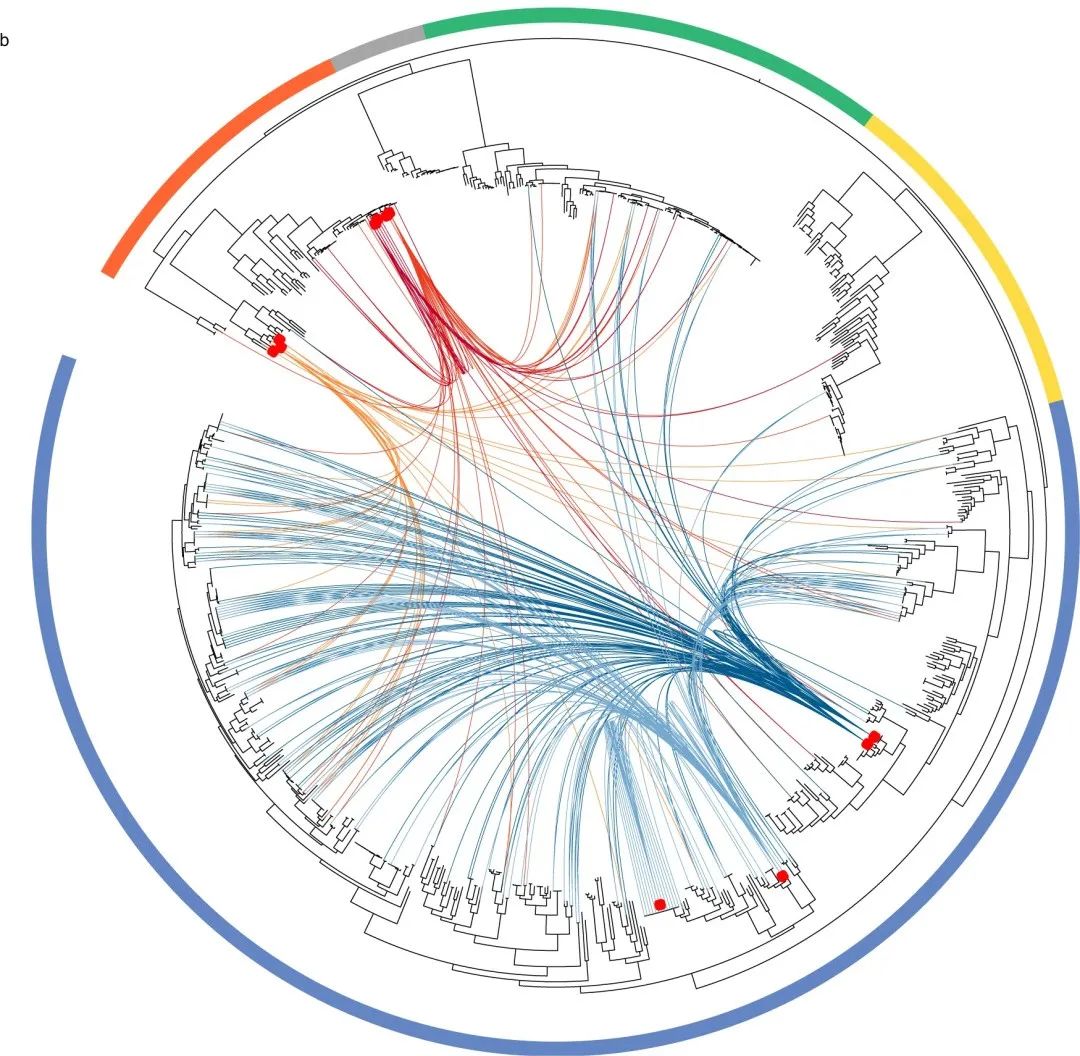
▲图1 胃肠道共生菌和病原菌之间水平转移遗传元件
周围的方框表示放线菌门(金色)、拟杆菌门(绿色)、厚壁菌门(蓝色)、梭菌门(灰色)和变形菌门(橙色)。红框表示病原体在系统发育树上的位置。连接线表示相关的水平转移基因。图中表示了大肠埃希菌(红色)、克雷伯氏菌(深红色)、弯曲杆菌(橙色)、肠球菌(深蓝色)和梭状芽孢杆菌(浅蓝色)病原菌的之间的连接。
为了进一步鉴定389,541个可能的水平转移基因中编码抗生素耐药性的基因,研究人员通过与CARD抗生素抗性基因数据库比较,鉴定出64,188个(16.5%)在共生菌和病原菌之间可水平转移的ARG,并且ARG在病原菌内或共生菌内以及两组细菌之间的传播没有明显的障碍。这表明肠道共生菌是一个ARG的储库,可以介导ARG在病原菌和共生菌之间的传播。其中5931个MGEs介导了共生菌和病原菌间的ARG转移事件。另外,尽管ARG相关的MGEs广泛存在于肠道共生菌和病原菌中,但MGE的多样性和丰度在不同肠道细菌中的分布并不均匀,其中厚壁菌门细菌的MGE多样性程度最高(p < 0.05;Fisher精确检验),并且其在共生菌和病原菌之间转移的MGEs最多(p < 0.05;Fisher精确检验)。
▼ 2. 特定的MGEs可实现细菌的跨门转移
MGE的水平转移范围受限于细菌宿主的系统发育屏障,研究人员发现,79.33%的MGEs是跨属转移的,11%的MGEs是跨纲转移的。有趣的是,1.5%的MGEs在多个菌门中具有广泛的宿主范围。这部分的研究结果表明,广泛存在的系统发育屏障限制了大多数MGEs在不同细菌的传播,大多数ARG转移仅局限在一个细菌菌属中。
鉴于ARG在不同细菌之间传播的能力对人类健康有巨大的影响,研究人员集中分析了具有广泛宿主范围和在病原菌和共生菌之间广泛传播的MGEs,该分析确定了15个广泛宿主范围的MGEs。这15个MGEs包括3个质粒(PLAS-MID_1-3)、3个整合性接合元件(ICEs;ICE_1-3)和9个整合移动元件(IMEs;IME_1-9)。这些可移动元件大多数(n = 14)可以存在于共生的厚壁菌门,6个可以存在于共生的放线菌门,5个可以存在于共生的拟杆菌门,3个可以存在于共生的变形菌门(图2)。研究人员根据Inc类别对广泛宿主范围的MGEs进行了分类,其中属于IncA/C、IncQ 和IncP1的MGEs在变形菌门细菌中通常携带ARG。
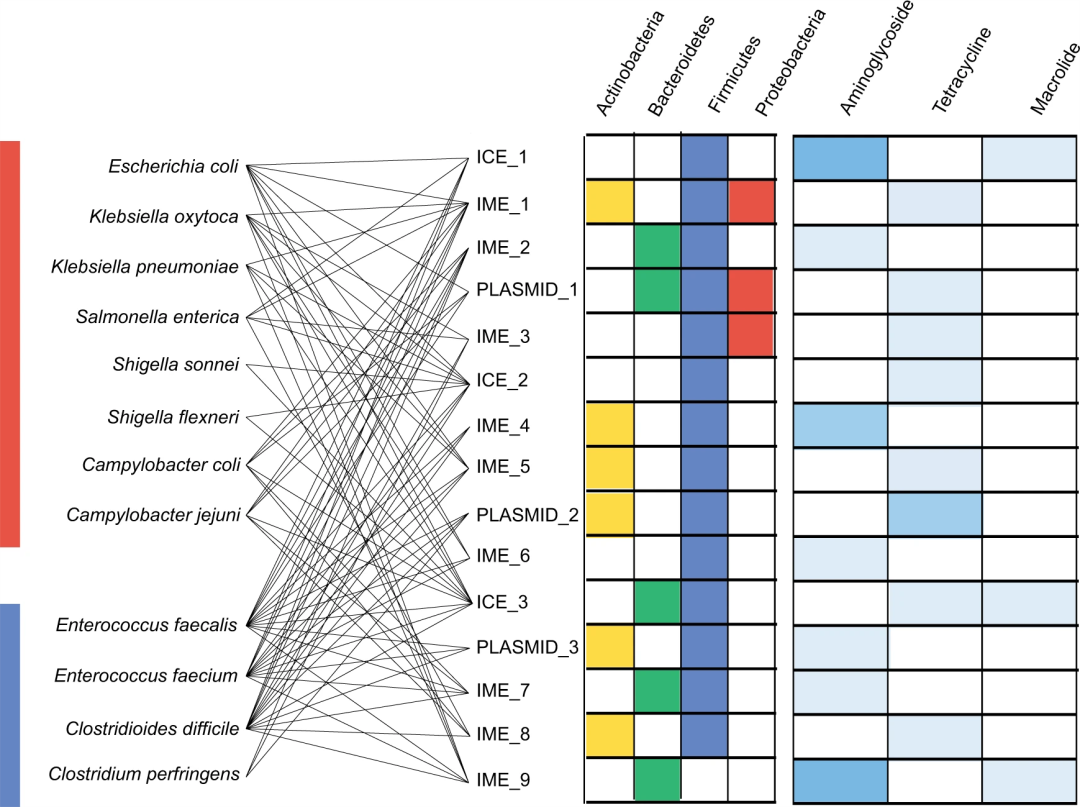
▲图2 15个广泛宿主范围的可移动遗传元件的菌种分布和功能
病原菌和共生的放线菌门(黄色)、拟杆菌门(绿色)、厚壁菌门(蓝色)和变形菌门(红色)之间共有的15种可移动元件。
▼ 3. 广泛宿主范围的MGEs具有体外可转移性
为了实验性地验证这些MGEs的活性,研究人员使用体外接合转移试验来检测这些MGEs在不同纲或门的共生菌和病原菌之间转移的能力,特别是ICEs和质粒。携带aadK(链霉素耐药性)的ICE_1可以在扭曲真杆菌(厚壁菌门梭菌纲)中发现,携带tetM(四环素耐药性)的ICE_2也可在Hungatella hathewayi(厚壁菌门梭菌纲)中发现。这两种ICEs都可以通过接合转移到粪肠杆菌(厚壁菌门芽孢杆菌纲)中,表明它们有在不同种类细菌间转移的能力并且转移的频率不同。研究人员进一步选择了一个携带四环素耐药决定子的质粒PLASMID_1(在长链多尔氏菌(厚壁菌门毛螺旋菌科)中发现)进行接合。ICE_2和PLASMID_1均可转移到四环素敏感的产酸克雷伯氏菌(变形杆菌门肠杆菌科)中。此外,ICE_2还可以接合到另一种对四环素敏感的大肠杆菌ETEC H10407中(图3)。这些结果表明,ICE和质粒仍然保留了在不同细菌门之间转移的能力。有趣的是,以前对四环素敏感的产酸克雷伯菌菌株,在获得PLASMID_1或ICE_2后,其MIC值升高,这说明含有MGE的ARG可以在胃肠道微生物群内的不同细菌宿主中改变抗生素耐药表型。
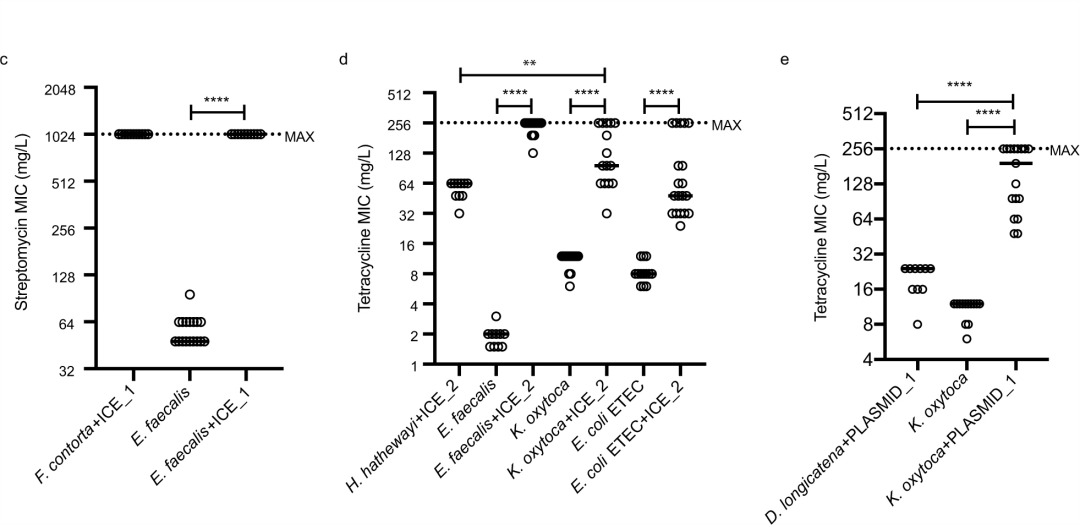
▲图3 广泛宿主范围的可移动遗传元件种间水平转移的实验验证
短的水平线表示每个数据集的中位数。虚线表示最大的抗生素浓度(MAX)。
▼ 4. 广泛宿主范围的MGEs在人类肠道外流行
为了了解15个广泛宿主范围移动元件的流行率和环境范围,研究人员分析了HPMC数据库中4349个人体胃肠道微生物群相关的宏基因组信息,发现这些元件的流行率在0.52%到98.2%之间,并且在元件类型、大小或所携带的抗生素耐药基因方面无统计学差异。研究人员随后分析了这些元件是否也存在于在其他人体部位的微生物群落中,发现5种元件仅分布于人类胃肠道,8种元件也可在人类鼻腔样本中检测到,9种元件可在人类阴道样本中检测到,3种元件可在人类皮肤样本中检测到(图4)。总的来说,这些结果表明人体微生物群之间存在相互联系。对反刍动物胃肠道微生物组样本的分析确定了六种元件的存在,所有这些元件都可以在人体肠道、鼻腔和阴道中检测到。另一方面,在环境土壤样品中只检测到3种元件。因此,研究人员证明了在人类、动物和环境来源中存在相同广泛宿主范围的MGE,强调需要一个One Health的理念来了解ARG的分布。
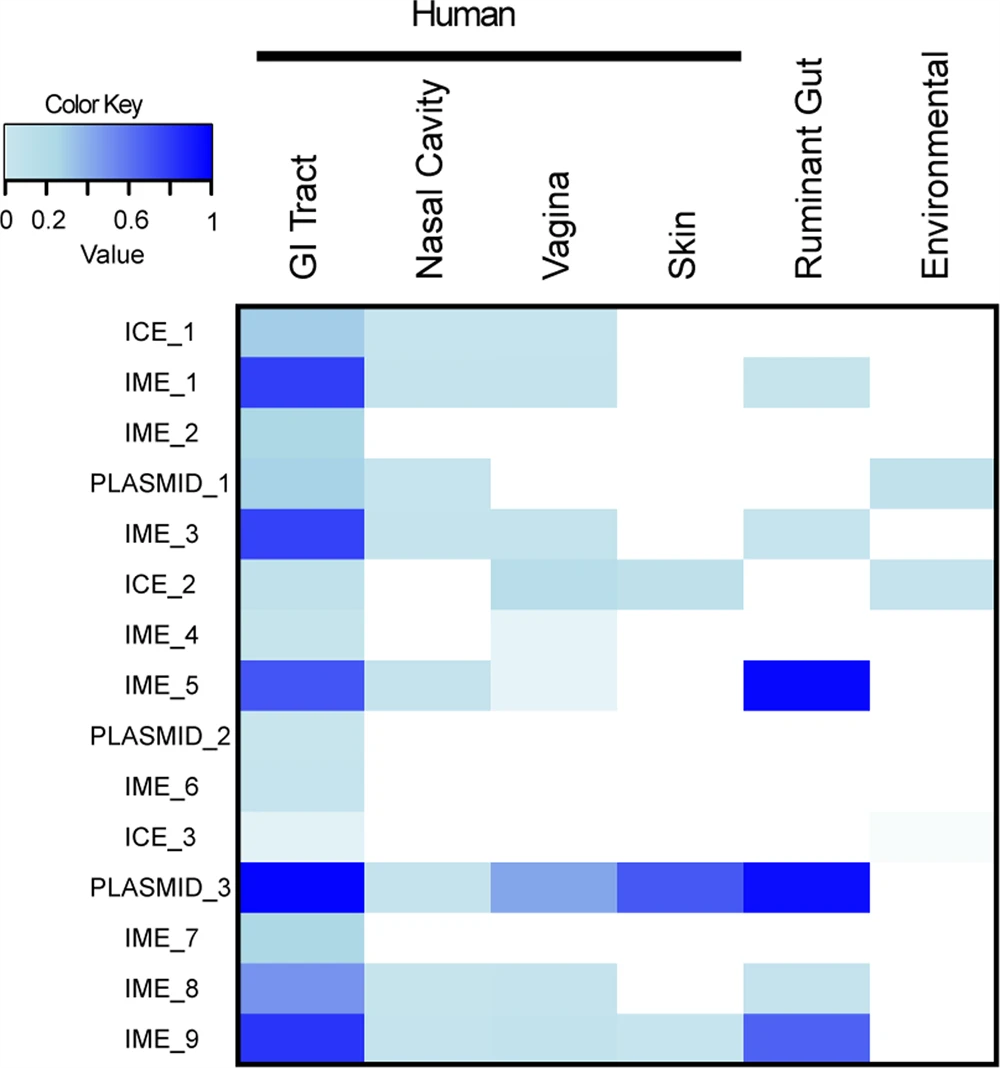
▲图4 人体、反刍动物肠道和环境微生物群中可移动元件的流行情况。
可移动元件在人类胃肠道、鼻腔、阴道、皮肤、反刍动物肠道和环境样本中的流行情况。蓝色表示在来自该位点的宏基因组样本中检测到可移动元件的频率。
▼ 结论
该研究共得到了五个主要的结论:
①1,354个肠道共生菌与12种代表性肠道病原体(45,403个)基因组比对分析,发现389,541个可移动遗传元件(MGE);
②进而与抗生素抗性基因数据库比对,发现64,188个MGE参与抗性基因(ARG )转移,其中5931个介导共生菌和病原菌间的ARG转移;
③其中15个MGE宿主范围广泛,推测可介导细菌不同门间ARG转移;
④体外接合实验显示,这些MGE可以有效实现基因在不同门类细菌中的转移;
⑤在人体不同部位、动物和环境样本中均可以检测到上述MGE的存在。
虽然ARGs在人体肠道微生物群中的流行情况已经基本确定,但我们仍然缺乏对ARGs相关MGEs宿主范围和在整个人体微生物群中流行情况的了解。该研究工作进行了大规模、全基因组、菌株水平的分析,建立了MGE介导的ARG在人类肠道共生菌和病原菌之间的传播网络。该研究工作表征了肠道微生物群所包含MGEs的多样性和宿主范围,证明了关键的广泛宿主范围的MGEs在不同的共生菌和病原菌之间的转移能力。这些广泛宿主范围的MGEs有助于ARG传播而对人类健康产生巨大的威胁。因此,有效的抗菌药物管理不仅需要控制耐药细菌的传播,还需要追踪、管理和限制ARG相关的MGEs在致病菌和共生菌间的传播。

王思恒
浙江大学医学院,硕士研究生
END
作者|王思恒(浙江大学医学院)
审校|张 嵘(浙江大学医学院附属第二医院)

