2023-08-31 17:20
作者 吴涛

京港感染论坛
多学科合作,构建诊断管理体系
棘球蚴病(俗称包虫病)是由棘球蚴属引起的严重的人畜共患寄生虫病,不仅威胁人类健康,还带来了巨大的经济影响。中国目前是棘球蚴病最严重的流行地区,中国在棘球蚴病的疫区范围、感染患者数量和受威胁人口数量等方面均位居全球首位。囊型棘球蚴病(CE)是我国主要流行的棘球蚴病类型,其病例数占比近80%。细粒棘球绦虫种属是囊型棘球蚴病的病原体,它是一个多基因型复合体。不同基因型虫株在形态、宿主嗜性及传播模式等方面有一定差异,且其相应的临床特征、临床治疗和疫苗反应也不同基因型而异。
在过去的二十年里,中国在疫区实施的棘球蚴病防治计划取得了显著成效,棘球蚴病的流行率近年来有所下降。然而现状是目前的防治计划对分子流行病学的关注不足,且缺乏来自人类和动物宿主的基因型数据。根据不同基因型病原采取精准防治措施将是未来防控工作的关键之一。因此,在当前防治计划基础上,为了实现增强未来对棘球蚴病的精确控制和预防,应着重于以下工作:收集更多的人和动物宿主的分子流行病学数据和地理信息、监测不同基因型的临床表现以及药物和疫苗反应、建立分子流行病学数据库。
关键词:细粒棘球绦虫(广义),控制与预防,棘球蚴病,基因型,分子流行病学
![]()
▼ 背景
棘球蚴病(俗称包虫病)是一种人畜共患的寄生虫病,属于全球性的公共卫生问题,全球范围内广泛分布,威胁人类健康并给社会增添了巨大的经济负担。棘球蚴病是由棘球蚴属(Echinococcus spp.)的幼虫引起的疾病。世界卫生组织将棘球蚴病列为17种被忽视的热带病之一,联合国粮食及农业组织则将棘球蚴病列为全球第二严重的食源性寄生虫病 [1,2]。棘球蚴病在中国的370个县(西部牧区和半牧区地区)中地方性流行,中国是全球棘球蚴病疫区最为严重的国家 [3]。事实上,中国在棘球蚴病的范围、感染患者数量以及受威胁人口方面均排名首位。
棘球蚴病在中国一般分为两种严重的人畜共患疾病(即囊型棘球蚴病[CE]和泡状棘球蚴病[AE])。囊型棘球蚴病和泡状棘球蚴病的病原体分别为细粒棘球绦虫种属和多房棘球绦虫。囊型棘球蚴病是棘球蚴病最普遍的形式,在中国约占所有病例的80% [3,4]。鉴于中国棘球蚴病的流行规模,过去二十年来实施了全国范围的大规模防治计划,并投入了大量资金来减少棘球蚴病的流行 [5,6]。诚然,该计划在控制和预防棘球蚴病的传播方面取得了显著进展。特别值得注意的是,棘球蚴病的患病率已显著降低,并在某些流行地区达到低患病率。在对棘球蚴病进行的科学研究中,特别是在棘球蚴病的分子流行病学方面,取得了相当大的进展。囊型棘球蚴的病原体细粒棘球绦虫种属被认为是是一种多基因型的复合群体,基于线粒体DNA序列,目前被确认为10个菌株/基因型(G1-G10)。
目前,细粒棘球绦虫种属被划分为五个物种,每个物种在病理学、传播方式、寄主偏好以及对药物和疫苗的反应方面都存在差异 [4,7,8]。在当前的棘球蚴病流行疫情中,对每个基因型进行精确的控制和预防至关重要。此外,多年来已经报道了越来越多来自不同地区或宿主的细粒棘球绦虫种属基因型和单倍体,甚至在非疫区也有所发现 [9]。然而,目前国家的防治计划并没有强调对基因型的重视,对来自人类和动物宿主的各种基因型的调查的重视程度也还远不够。因此,棘球蚴病的分子流行病学数据还相对有限。
▼ 中国棘球蚴病的控制与预防
棘球蚴有一个复杂的生命周期,涉及两个宿主(终宿主和中间宿主)。主要的终宿主是犬科动物,它们在小肠中寄生成年虫。成年虫成熟后产生的卵在犬科动物的粪便中释放到环境中。人类和草食动物,特别是绵羊,是这种寄生虫的中间宿主。中间宿主在摄入终宿主粪便中释放的卵后感染。卵在肠道中孵化,释放出蚴球体,通过门静脉和淋巴管到达肝脏、肺或其他器官,通常在这些器官中定植并发育成棘球蚴(水泡囊)。棘球蚴产生的节片随后被释放到棘球蚴液中。当节片被终宿主摄入时,它们附着在肠壁上并发育成成熟、产生卵的成年虫。家犬是细粒棘球绦虫种属的主要终宿主,而家畜,如绵羊、山羊、牛和猪,是中间宿主。犬科动物作为终宿主在棘球蚴病的传播中起着关键作用。需要注意的是,人类通常不参与囊型棘球蚴的传播 [4,10]。
棘球蚴由于其复杂生命周期,也要求棘球蚴防治工作也需要进行多层次、复杂的设计,并需要整个社会的参与。中国于2005年启动了全国范围的棘球蚴病控制与预防计划。该计划投入了大量专项资金,并实施了多项有针对性的措施来控制棘球蚴病。中国棘球蚴病的防治策略首先基于控制感染源,并将控制与预防中间宿主与患者筛查和治疗结合起来。具体的控制与预防措施包括对犬科动物进行每月一次的驱虫、安全屠宰家畜、对患者进行筛查并提供免费治疗,以防止棘球蚴从犬科动物至人类以及从中间宿主至犬科动物的传播等[5,6]。
为了确定棘球蚴病的疫区和流行状况,中国于2012年至2016年期间进行了全国范围的棘球蚴病调查。根据结果,共有370个县位于9个省份和自治区(内蒙古、四川、西藏、甘肃、青海、宁夏、云南、陕西和新疆[包括新疆生产建设兵团])被确定为棘球蚴病的疫区,如图1所示。棘球蚴病在中国西北部的牧区和半牧区地区高度流行,人群、家畜和犬类的棘球蚴病患病率分别高达0.28%、4.7%和4.3%。在中国,患者数量超过16万人,受威胁的人口超过5000万,棘球蚴病的流行严重程度远高于全球其他地区 [3]。如图1所示,青藏高原地区是中国受影响最严重的地区,人群的患病率(1.28%)显著高于非青藏高原地区(0.13%)[3,11]。这些调查结果明确了中国棘球蚴病流行范围和程度,并提供了坚实的数据来帮助控制和预防这种疾病。根据人群中棘球蚴病的患病率和犬类的感染率,所有370个棘球蚴病疫区县被分为3个级别(如图1所示):一级疫区:人群中患病率≥1%,或犬类感染率≥5%。二级疫区:人群中患病率在0.1%至1%之间,或犬类感染率在5%至1%之间。三级疫区:人群中患病率<0.1%,或犬类感染率<1%。一级疫区是最严重的级别。尽管有这样的分级差别,但在具体防治计划中,这三类级别的患者筛查、病例调查和犬类驱虫频率之间几乎没有太大差异。
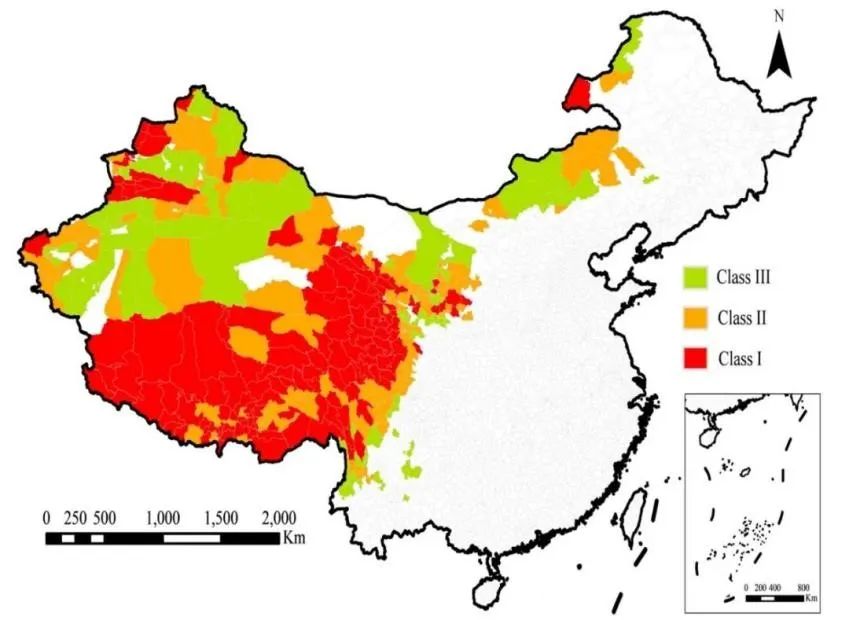
▲图1 中国基于2012年至2016年全国流行病学调查结果(其中西藏自治区基于2016年调查结果)的包含数据的棘球蚴病流行病学地图。(数据引用自《包虫病防治技术方案(2019年版)》)
从棘球蚴病监测数据中得知,在病疫区的持续防治计划中取得了显著进展。自2016年以来,在所有疫区县进行了人类、家畜和犬类患病率的监测。每年的监测可以准确评估防治计划的影响,同时更好地了解棘球蚴病患病率的趋势。近年的监测数据显示,棘球蚴病在大多数疫区的人类、家畜和犬类患病率显著下降,有些地区甚至实现了低流行水平 [12,13]。然而,也存在逐渐上升的趋势值得关注,特别是在所有非疫区省份都发现了棘球蚴病患者 [14,15]。根据流行病学调查发现,一些患者有生活或在疫区旅行的历史,然而,如何确定本地感染的病例的具体感染途径仍是具有挑战性的工作。或许分子流行病学调查是完成这些工作的关键。目前,棘球蚴病的诊断在当前的控制与监测计划中仍主要通过对人的超声和免疫学检测,家畜的解剖检查以及犬类的免疫学检测来确认。有趣的是,对棘球蚴属基因型的鉴定并不是强制性的,只有在家畜监测中才需要,因此在国家的控制与监测计划中,对人类和动物的分子流行病学数据是有限的。当前的棘球蚴属基因型数据都是基于学术文献进行科学研究目的而报告的。
▼ 中国的棘球蚴属基因型
细粒棘球绦虫种属是感染人类而引起囊型棘球蚴病的主要物种。囊型棘球蚴病在全球范围内分布,并大部分棘球蚴病患者均属于此类型。根据形态学、分类学、流行病学和分子生物学数据,细粒棘球绦虫是一个多基因型复合体,包括10个基因型和狮子棘球蚴。遗传学和测序技术的进展对细粒棘球绦虫进行分类提供手段。目前,细粒棘球绦虫被划分为5个物种:细粒棘球绦虫狭义种(E. granulosus sensu stricto,s.s.)[G1-G3基因型];马棘球蚴(E. equinus)[G4基因型];奥特勒普棘球蚴(E. ortleppi)[G5基因型];加拿大棘球蚴群(E. canadensis group)[G6-G10基因型];和狮子棘球蚴(E. felidis)[lion株]。这些物种具有明显的形态学、传播方式和流行病学特征,与免疫诊断、临床治疗和疫苗反应差异 [16,17]。
细粒棘球绦虫狭义种包括G1、G2和G3基因型,分别对应于羊、塔斯马尼亚羊和水牛株,这些名称最初是基于流行病学特征命名的。此外,细粒棘球绦虫狭义种的G1、G2和G3基因型是最常见的引起囊型棘球蚴病的病原体,可以感染人类和各种动物。许多家畜,包括牦牛[18]、牛、水牛[19]、猪[20]、马[21]和骆驼[22],都可以作为中间宿主被感染。最常见的传播途径是从羊到犬和从牛到犬。细粒棘球绦虫狭义种在全球范围内分布,其中G1是最常见基因型。G1引起的人类囊型棘球蚴病感染率在全球范围内超过88%[23],而G2和G3基因型也会感染人类,但报告的病例数量有限。
马棘球蚴最初是在马中检测到的。马棘球蚴的形态与羊株不同。马棘球蚴对应于G4基因型,主要在马和犬之间传播。此外,马棘球蚴是唯一一个没有被证明感染人类的物种。此外,马棘球蚴是寄主特异性的,可以在马、驴、骡和斑马中检测到。曾经认为马棘球蚴只感染马科动物,并且对人类不具有致病性,但在狐猴中检测到了马棘球蚴,确认可能存在人畜共患病的可能性,但还需要更多的证据来得出更确定的结论[24,25]。
奥特勒普棘球蚴最初在牛中被证实,并被称为牛株,对应于G5基因型。奥特勒普棘球蚴的形态与细粒棘球绦虫狭义种不同。奥特勒普棘球蚴的主要中间宿主是牛,牛中的感染较为普遍。引起牛感染的最常见基因型仍是细粒棘球绦虫狭义种的G1基因型。G1和G5引起的感染特征不同。G1感染形成的囊肿大多是不育囊肿,而G5引起的囊肿大多是有传染性的育性囊肿,因此后者在传播囊型棘球蚴病时者更具传染性[26]。除了牛,奥特勒普棘球蚴也可以感染水牛[20]、山羊[27]、骆驼[28]和其他家畜。最后,奥特勒普棘球蚴也可感染人类,但报告的病例很少。
目前认为是加拿大棘球蚴群的G6-G10基因型仍存在争议;有学者认为G9可能是G7的一个变异体[29]。此外,还有人试图将加拿大棘球蚴群分为三组(E. intermedius,由G6和G7组成;E. borealis,由G8和G10组成;和E. canadensis)[30]。因此,需要更多的生物学、形态学和遗传学数据来发展一个被普遍接受的分类学理论。
加拿大棘球蚴群的G6和G7基因型在全球范围内分布。G6和G7基因型感染在家畜中很常见,其中主要的中间宿主是骆驼和猪。由G6和G7感染引起的人类囊型棘球蚴病的患病率仅次于G1,分别为7.34%和3.7%。因此,对全球棘球蚴病的疾病负担产生的影响不容忽视[23]。值得注意的是,G6和G7是一些国家和地区的优势基因型,甚至是唯一的基因型,因此由这些基因型引起的损害可能被低估了[24]。
加拿大棘球蚴群的G8和G10基因型主要在狼和鹿之间传播,但到目前为止,G8和G10基因型仅在北半球发现和报告[24]。作为引起人类囊型棘球蚴病的病原体之一,由G8和G10基因型引起的报告病例数量有限。
分子流行病学数据[31]显示,除了G4以外,所有棘球蚴的基因型在中国都有报道。正如预期的那样,G1也是中国的常见基因型,大多数报告的病例集中在青藏高原,这里的疫情最为严重。中国报告的人类囊型棘球蚴病(CE)不同基因型的地理分布在图2和表1中详细说明[9,31,32]。在棘球蚴病流行的省份(新疆、青海、四川、甘肃、宁夏、西藏和内蒙古)报告了由G1、G3和G6引起的人类棘球蚴病病例,而在非流行性省份(黑龙江、辽宁、广西和贵州)报告了由G1、G5、G7和G10引起的人类棘球蚴病病例。虽然非流行性省份的病例数远远低于流行性省份,但病原体在非流行性省份反而显得更为多样化。从2004年到2020年,中国的棘球蚴病病例数超过了66000例,其中98.9%集中在流行性省份[14]。根据系统文献回顾,大多数囊型棘球蚴病病例缺乏基因型信息。实际上,仅在1240例人类囊型棘球蚴病病例中鉴定了细粒棘球绦虫种属的基因型[31],这在数据上明显存在巨大的差距(明确基因型的数目和病例数目差距巨大)。如上所述,在控制计划和监测中,患者的诊断是通过超声和免疫学检测确认的,病原体的基因型并未强制通过分子生物学方法确定,这导致了在大多数流行区的病例缺乏分子流行病学数据。非流行性省份的棘球蚴病病例相对较少,因此需要更多的关注。需要更多信息,包括病原物种的鉴定,来确认诊断。鉴于上述所有原因,非流行性地区应报告更多的基因型数据用于后续统计和研究。

▲图2 人细粒棘球绦虫种属基因型分布图(中国)
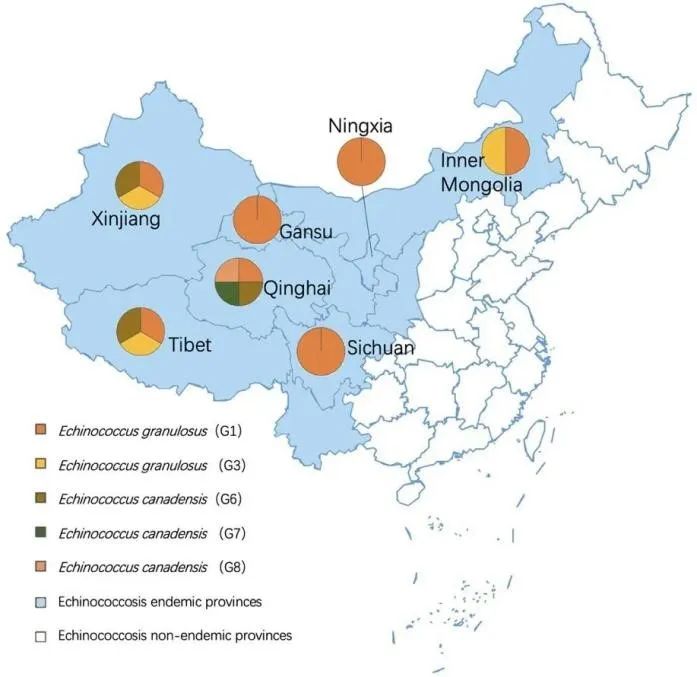
▲图3 动物宿主细粒棘球绦虫基因型分布图(中国)
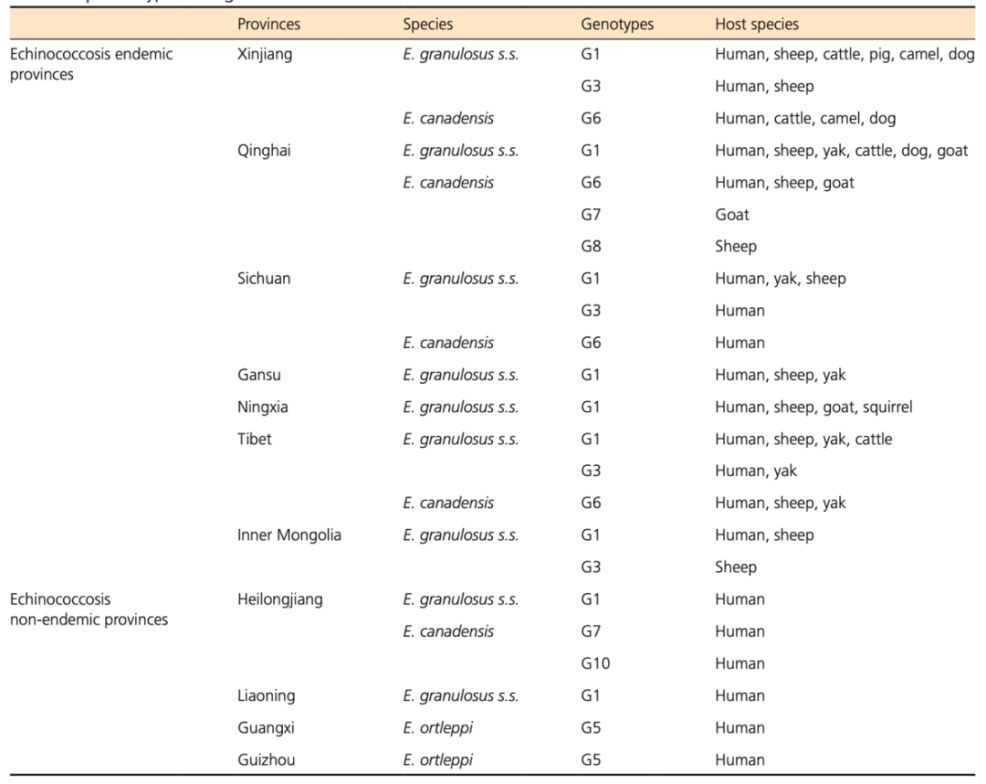
▲表1 中国细粒棘球绦虫基因型汇总
动物宿主中不同基因型在中国的地理分布见图3和表1 [31,33]。在动物宿主中,G1基因型也是最为常见优势基因型,分布最广,感染动物宿主数量最多,包括来自新疆、青海、四川、宁夏、甘肃、西藏和内蒙古的羊、牛、猪、骆驼、牦牛、山羊、松鼠和狗。此外,还在羊和牦牛中检测到了G3基因型,牛、骆驼、羊、山羊、牦牛和狗中检测到了G6基因型,山羊中检测到了G7基因型,羊中检测到了G8基因型。所有动物宿主的基因型数据均来自于流行性省份的报告。与人类病例的基因型情况类似,控制和监测计划中检测到了各种中间和终宿主。动物感染可以通过解剖和免疫学检测进行验证。由于不强制通过分子生物学方法确定病原物种,动物基因型信息的数据也相对较少。然而,这并不意味着流行性省份动物宿主中只存在报告的基因型,仍需进一步的调查来补充这些数据。
如图2和图3所示,细粒棘球绦虫种属基因型在人类和动物宿主中的地理分布并不完全一致。这可能归因于在流行性省份中鉴定基因型时,对包括人类和动物样本在内的样本进行基因鉴定的数量不足。而非流行性省份中观察到的这种现象的本质特征则可能是收集的样本数量不足,特别是感染的动物样本不足以确定当地感染病例的传播途径。在一个地区鉴定更多的基因型是更多的动物宿主可能参与传播途径的标志,因此正在进行的控制和监测计划中应包括更多类型的动物宿主。
随着分子生物学技术的进步,目前可以通过测序技术根据更多多样性和地理特异性来检测完整的线粒体DNA或短基因(cox1、nad1、nad2和nad5)以及单倍型来鉴定棘球蚴的基因型。完整的线粒体序列提供了比短基因更好的系统发育分析分辨率和准确性。以前出于技术和经济原因,大多数研究使用短基因检测作为系统发育标记的手段。其中,cox1是最广泛使用的短基因。在中国,共有51个细粒棘球绦虫种属.cox1单倍型,其中包括最常见的单倍型(Hap_2),具有最广泛的地理分布和宿主范围[31]。比较和分析不同地区的单倍型可以揭示棘球蚴的可能起源、分化时间和空间传播途径[32,33],这对于追踪感染源和制定定制的控制策略具有决定性作用。
对于棘球蚴病的控制和预防,筛查和治疗患者、中间宿主的控制以及终宿主的控制是防治工作的三个基本方面。符合手术干预标准的棘球蚴病患者可以通过手术治疗,而其余患者可以给予适当的药物治疗,但由于疗效不理想,对于一些患者来说可能并不是理想的选择。不同基因型引起的棘球蚴病的特点是不同的。例如,G6基因型可能比G1基因型更倾向于侵袭脑部[34]。值得注意的是,先前的研究表明G3感染的棘球蚴病为大的活跃CE1,而G6感染的棘球蚴病主要是较小的囊肿的过渡性CE3 [32]。这些差异可能导致某些患者对药物治疗无效。对于中间宿主的控制,包括对牲畜的免疫接种以预防感染,以及安全屠宰以阻断牲畜传播给狗的途径。目前,EG95疫苗是唯一批准的疫苗,并且对G1基因型具有优异的预防效果,但可能对G6基因型无效[35]。无论病原物种和基因型如何,驱虫是控制终宿主的主要手段,而关于终宿主基因型的报道较少。狗是棘球蚴病的重要感染来源,了解其病原基因型对于确定传播途径尤为重要。从以上事实表明,分子流行病学数据对于棘球蚴病的控制至关重要。
▼ 结论和未来展望
随着棘球蚴病防治计划的推进,棘球蚴病的流行率逐渐降低。在低流行地区,精确控制和预防棘球蚴病尤为重要。在非流行地区,新的本地感染病例仍在不断出现,通过流行病学调查确定传播途径仍具有挑战性,意外的中间宿主可能会增加更多挑战。需要更多的分子流行病学数据来通过扩大调查的宿主范围和增加样本量来识别更多的宿主物种。
在棘球蚴病控制和预防中,分子流行病学的重要性不言而喻。当前的控制计划和监测系统应该补充有关致病物种和基因型的数据。分子生物学技术是鉴定病原物种、基因型和单倍型的可靠方法。此外,省级控制和预防部门、研究机构和医疗机构可以满足技术和设备要求,这使得在棘球蚴病流行和非流行地区开展分子流行病学调查成为可能。此外,还应收集更多的基因型数据和地理信息,包括人类和动物的信息。更重要的是,应建立分子流行病学数据库。监测不同基因型引起的临床表现、药物敏感性、疫苗保护效力以及药物或手术治疗的效果,都对更精确地控制和预防棘球蚴病提供了基础。
中国的一些邻国,如巴基斯坦、蒙古、印度和尼泊尔,也是棘球蚴病的流行区 [4]。因此,人员交流和动物贸易的频繁增加可能导致病原体和疾病的传播。通过分析国内外病例或中国不同地区的病原体基因型和单倍型信息,并结合地理信息,可以推断可能的传播途径,从而采取有针对性的措施。此外,对棘球蚴病菌株的分子流行病学研究可以促进不同国家之间的学术交流与合作,并推动中国和邻国共同控制和预防棘球蚴病的合作计划,这对“一带一路”倡议将具有重要意义。
对于了解不同棘球蚴的遗传特征、传播方式、宿主和地理分布,对于棘球蚴病的诊断、疫苗研发、治疗和精确的控制与预防具有重要意义。目前,棘球蚴病的分子流行病学数据存在许多不足,但通过推动棘球蚴病防治计划并重视分子流行病学,这种情况可以得到改善。
此外,由于棘球蚴是一种多宿主寄生虫,具有复杂的生命周期,它在生态环境中有着特殊的生态位,其传播链受人类、动物和环境因素的影响。因此,无论是传统流行病学还是分子流行病学的研究,都可以采用“同一健康”(One Health)的方法来支持棘球蚴病的控制与预防。基于分子生物学信息,可以充分认识人类、动物及其共享的环境之间的相互关系,并通过多个部门之间的沟通与合作取得更好的公共卫生效果。
全文链接:https://www.scienceopen.com/hosted-document?doi=10.15212/ZOONOSES-2023-0009
▲点击图片,关注2023京港年会

吴涛
应用化学硕士
END
摘译|吴涛
审校|鲁炳怀 (中日友好医院)


