2023-09-07 17:20
作者 丁明珠

京港感染论坛
多学科合作,构建诊断管理体系

无菌(Germ-free,GF)小鼠因其体内不含常驻微生物群,可将其用于探索微生物群在疾病中的作用。然而,由于这类小鼠不支持微生物的复制,因此它们在对人类特殊病原体的研究中具有一定局限性。本文的研究团队开发了一种用人类免疫细胞系统重组的GF小鼠,并利用它们来评估定植微生物群在两种人类特异性病原体—EBV(EB病毒)和HIV(艾滋病病毒)病毒中的获得、复制和发病机制中的作用。与CV(常规)人源化小鼠的比较表明,常驻微生物群增强了EBV感染和EBV诱导的肿瘤发生的建立,并增强了粘膜HIV的感染率以及复制的活跃水平。CV人源化小鼠血浆和组织中的HIV RNA水平高于GF人源化小鼠。分析肠道组织发现,贯穿整个肠道的HIV的靶细胞CCR5+ CD4+ T 细胞在CV人源化小鼠中的频率也更高,这表明常驻微生物群控制着HIV靶细胞的水平。因此,常驻微生物群促进了这两种临床相关的人类特异性病原体的获得和发病。
![]()
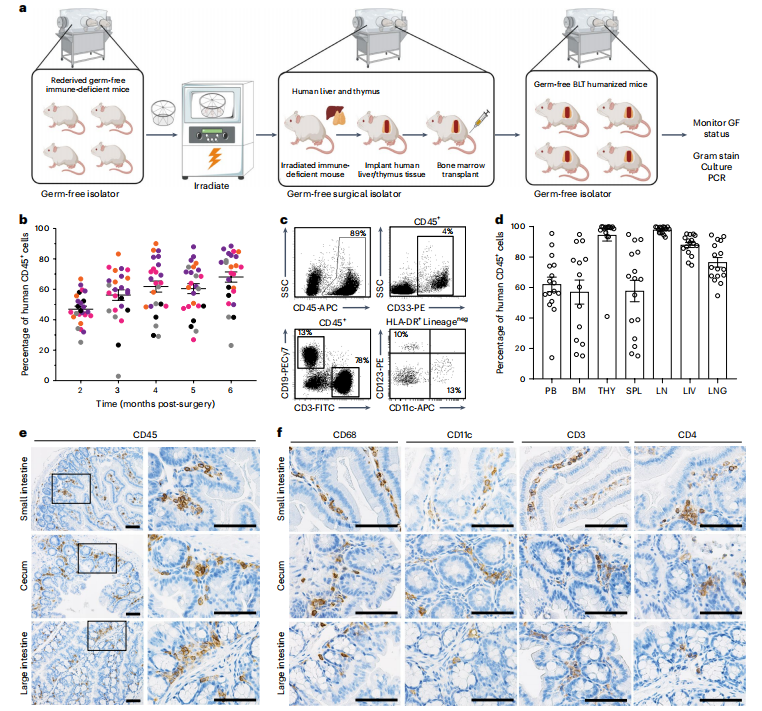
▼ 一、利用人类造血细胞系统重建GF-BLT小鼠
本文的研究团队利用骨髓-肝-胸腺(BLT)平台,通过无菌胚胎移植技术开发了一中新的GF免疫缺陷小鼠品系模型(GF-BLT),以提供一个健壮和灵活的体内模型,用于研究常驻微生物群在人类特有病原体感染中的作用。在GF-BLT小鼠的外周血中观察到有大量的人造血细胞(CD45+),其中包括B细胞、T细胞、髓系细胞和树突状细胞。人造血细胞也存在于GF-BLT小鼠的淋巴组织(骨髓、人胸腺器官、脾和淋巴结)和效应组织(肝和肺)中。此外,在肠道中也检测到了人类造血细胞的存在。通过免疫组化技术发现,在GF-BLT小鼠的肠道中,人造血细胞,特别是HIV靶细胞—髓系细胞、树突状细胞和CD4+T细胞,在小肠、盲肠和结肠中具有一定表达量(图1e,f)。
▼ 二、在存在常驻微生物群的情况下,EBV感染和EBV诱导的肿瘤发生的可能性增加
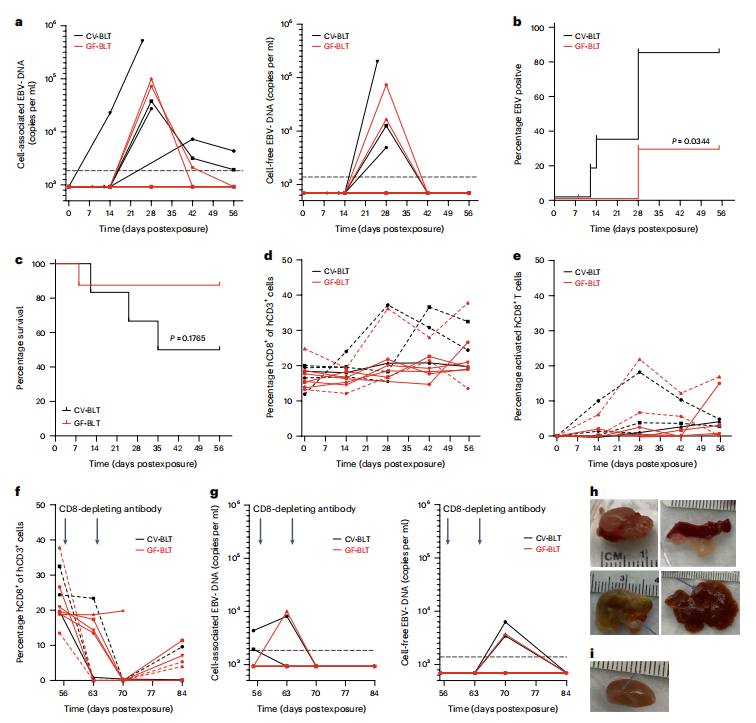
通过给CV-BLT和GF-BLT小鼠腹腔注射EBV病毒,研究者们评估了常驻微生物群在EBV感染和EBV诱导的肿瘤形成中的作用。在保证CV-BLT和GF-BLT小鼠中的人B细胞表达了相同水平的EBV受体—CD21的情况下,注射等量EBV病毒后8周发现,在67%的CV-BLT小鼠和25%的GF-BLT小鼠外周血中检测到EB病毒DNA,两组之间的病毒DNA水平虽没有显著差异,但感染了EB病毒的CV-BLT小鼠的存活率(50%)却显著低于GF-BLT小鼠(88%)。EBV感染诱导了CV-BLT和GF-BLT小鼠外周血中类似的CD8+ T细胞的扩增和激活。
因此,在活体细胞中,CD8+T细胞对EBV感染的控制有重要作用。为了进一步确定小鼠体内确实发生了EBV病毒感染,研究者进一步对小鼠进行了CD8耗尽抗体治疗。CD8+T细胞耗尽的证据通过流式细胞术得到证实(图2f)。CD8+ T细胞的消耗仅导致CV-BLT和GF-BLT小鼠中EBV DNA水平的一过性升高,这些小鼠原先在外周血中就能够检测到EBV DNA,而在CD8+ T细胞消耗前外周血EBV DNA阴性的小鼠,在CD8+ T细胞消耗后外周血EBV DNA水平均没有明显增加。研究人员在对小鼠的进一步尸检中发现了CV-BLT和GF-BLT小鼠组织中EB病毒DNA和肿瘤的存在。在3只EBV阳性的CV-BLT小鼠体内,在多个组织(如脾、肝、肾和胃)观察到了巨大的肉眼可见肿瘤。相比之下,在两只EBV阳性的GF-BLT小鼠中,只有在一只小鼠的肾脏上观察到一个小肿瘤(图2i)。这些数据表明,常驻微生物群促进了EBV感染和EBV诱导的肿瘤发生的建立。
▼ 三、在存在常驻微生物群的情况下,经口感染艾滋病毒的获得率增加
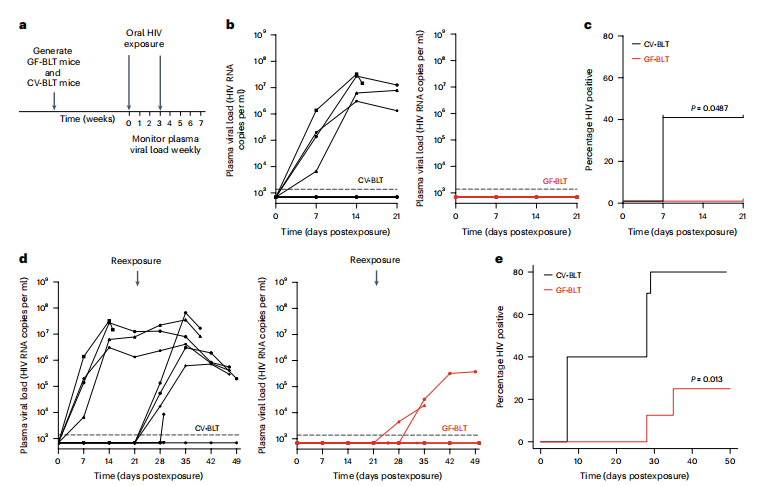
为了评估体内微生物群对经口感染HIV病毒后HIV感染的影响,给CV-BLT和GF-BLT小鼠灌胃一种先前证实可以在BLT小鼠中经口传播HIV的CCR5毒株—HIV-1JRCSF。在单次口服艾滋病毒感染后,40%的CV-BLT小鼠的外周血血浆中可检测到HIV RNA,而所有的GF-BLT小鼠的外周血血浆中均未检测到HIV RNA,这说明在存在常驻微生物群的情况下,艾滋病毒获得率显著增加(P = 0.0487)。随后进行第二次口服病毒实验,此时有66%的CV-BLT和25%GF-BLT小鼠外周血浆中能够分别检测到病毒RNA。在随后的尸检中,研究人员也未在GF-BLT小鼠的外周血液或组织样本中检测到艾滋病毒DNA。这些结果表明,在存在常驻微生物群的情况下,口服艾滋病毒后其获得艾滋病毒的可能性要高于三倍以上。
▼ 四、在存在常驻微生物群的情况下,直肠内艾滋病毒的获取和肠道内的病毒复制会增加
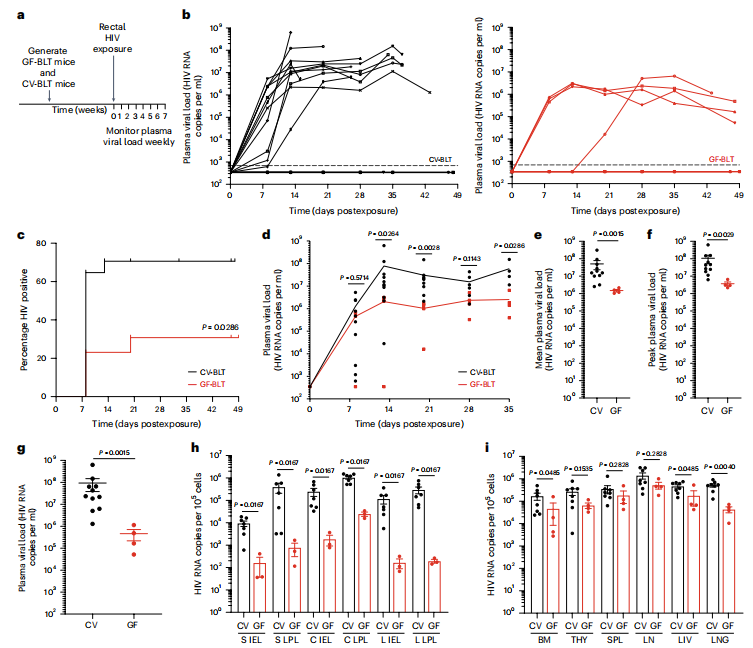
通过将GF-BLT和CV-BLT小鼠直肠暴露于单剂HIV-1THRO(一种嗜T细胞、嗜CCR5、MSM来源的传播/方正病毒),评估了微生物群对直肠HIV感染和全身感染的影响。在感染HIV前,确保GF-BLT和CV-BLT小鼠的外周血中存在等量的人CD-4+T细胞。在17只CV-BLT小鼠中,有11只(64%)的血浆中可检测到HIV RNA,相比之下,在11只GF-BLT中只有4只(36%)的外周血浆中能够检测到HIV RNA。根据尸检时血浆中HIV RNA和组织中HIV DNA的存在比较,CV-BLT小鼠的直肠HIV DNA获得率是GF-BLT小鼠的两倍(P=0.0286),表明常驻微生物群的存在将直肠HIV DNA感染风险增加了两倍。纵向比较病毒型CV-BLT和GF-BLT小鼠在直肠感染HIV后外周血浆中HIV RNA水平,发现CV-BLT小鼠血浆中的HIV RNA平均水平是GF-BLT小鼠的34倍(P=0.0015)(图4d,e)。与GF-BLT小鼠相比,CV-BLT小鼠血浆HIV RNA峰值水平(高28倍;P=0.0029)和尸检时血浆HIV RNA水平(高201倍;P=0.0015)也充分反映了这种血浆HIV RNA水平的增加。同时在CV-BLT小鼠的小肠、盲肠和大肠的上皮内层(IEL)中,HIV RNA水平分别高出57倍、134倍和704倍。从CV-BLT小鼠的骨髓(3.6倍;P=0.0485)、肝脏(2.6倍;P=0.0485)和肺(11倍;P=0.0040)分离的细胞中也观察到更高水平的HIV RNA(图4i)。这些数据表明,在直肠感染艾滋病毒后,肠道和非肠道组织中驻留的微生物群的存在增强了艾滋病毒的复制。
▼ 五、常驻微生物群增加肠道中HIV靶细胞CD8表达水平
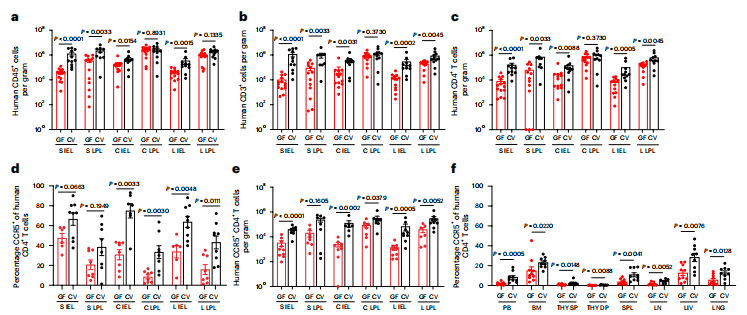
为了进一步探讨常驻微生物群对艾滋病毒获得和复制增加的可能的分子机制和细胞基础,我们比较了CV-BLT和GF-BLT小鼠中CD4+T细胞的频率和表型(图5)。对肠道的分析表明,在存在常驻微生物群的情况下,人体小肠IEL中的CD4+T细胞水平显著较高.相比之下,常驻微生物群的存在对外周血和非肠道组织中的CD4+T细胞或CD8+T细胞水平的影响很小。这些数据表明,常驻微生物群,特别是在肠道中的微生物能够调节人体的CD4+T细胞稳态。CCR5作为HIV入侵细胞的共受体,上皮内CD4+ T细胞表达CCR5的百分比显著升高,这一点与肠道内获得和病毒复制的增加相一致。同时,在CV-BLT小鼠的IEL和LPL中,表达CCR5的CD4+ T细胞的比例也更高。值得注意的是,在CV-BLT小鼠的外周血液和非肠道组织中,CCR5的表达水平也较高(图5f)。这些结果表明,常驻微生物群的存在对HIV靶细胞上的共受体表达水平有深远的系统性影响,为观察到的HIV获得和复制的增加提供了一个可能的机制解释。
▼ 六、总结
人体体内有数万亿微生物,其中大部分定植在肠道中。GF小鼠模型极大地增强了我们对常驻微生物群如何促进人类健康和疾病的理解,包括常驻微生物群在人类病原体感染中的作用。免疫缺陷小鼠,特别是NSG品系,一直是生产用于生物医学研究的精确动物模型的基础。这些模型已被证明有助于深入了解SARS-CoV、SARS-CoV-2、MERS、EBV、ZIKA、KSHV和HIV33-36、58-62、77-89的生物学特性。本文展示的结果支持了人源化小鼠的建立,以研究针对微生物组、微生物产物或下游途径对这些和其他人类特异性病原体的影响的方法。他们的研究验证并支持使用精确的动物模型来研究微生物组在许多具有高度临床重要性的人类特异性微生物的感染中的作用和病理相关性。
参考资料(上下滑动)
Wahl Angela,Yao Wenbo,Liao Baolin et al. A germ-free humanized mouse model shows the contribution of resident microbiota to human-specific pathogen infection.[J] .Nat Biotechnol, 2023, https://doi.org/10.1038/s41587-023-01906-5.
▲点击图片,关注2023京港年会

丁明珠
武汉市第四医院检验科,福建医科大学病原生物学硕士。主要研究方向为病原微生物的致病机制
END
作者|丁明珠(武汉市第四医院)
审校|余方友(上海市肺科医院)


