2023-09-08 17:20
作者 高源

京港感染论坛
多学科合作,构建诊断管理体系
近年来,脓肿分枝杆菌(Mycobacterium abscessus,Mab)作为一种新兴的高度耐药病原菌,正在引起人们的关注。Mab可感染肺部,引起慢性肺病,也可能攻击皮肤和软组织。常见的抗分枝杆菌药物对Mab感染难以起效,而Mab对抗菌药物的高耐药机制尚未完全明晰。
Ⅱ型毒素-抗毒素系统(Toxin-antitoxin,TA)是由两个相邻基因组成的操纵子,分别编码毒素和抗毒素蛋白。抗毒素可与毒素形成稳定的蛋白-蛋白复合体,抑制毒素的毒性作用。特定的压力状态可能导致抗毒素的含量减少,大量毒素蛋白得以释放,进而发挥毒性作用。多项研究表明,Ⅱ型TA系统中毒素组分的激活会抑制细菌生长,降低部分抗生素的作用效果,促进抗生素压力下持留菌的形成。然而,Mab中TA系统的流行情况尚无系统调查,同时也缺乏TA系统对抗菌药物治疗效果的影响研究。
![]()

今年六月,美国罗格斯大学的Eduardo A. Troian等研究者在《Nature Communications》杂志发表一篇题为《Mycobacterium abscessus VapC5 toxin potentiates evasion of antibiotic killing by ribosome overproduction and activation of multiple resistance pathways》的研究论文。
该论文发现Mab TA系统中的毒素蛋白VapC5特异性失活细胞中的tRNASerCGA,抑制细菌生长,同时重塑细菌蛋白组,使核糖体蛋白大量表达。VapC5引起的细菌的生长抑制和核糖体蛋白囤积促进了细菌在头孢西丁、阿米卡星、特地唑胺暴露下的持留。该研究证明TA系统可以激活细菌对一线抗菌药物的耐药性,为临床治疗Mab感染的药物选择提供了参考。
原文链接:
https://www.nature.com/articles/s41467-023-38844-4
▼ 1.临床Mab菌株TA系统携带情况调查与VapBC5 TA系统的确证
作者团队在NCBI数据库中检索了从Mab感染病人呼吸道样本中分离的Mab菌株的序列信息,从中发现了128株具有结核分枝杆菌TA系统中同源毒素基因的Mab,其中以VapBC5系统占比最高,为25%(n=32)。在Mab的VapBC5系统中,抗毒素蛋白VapB5和毒素蛋白VapC5与结核分枝杆菌中的同源蛋白氨基酸序列相似性分别为47%和52%(图1 A),结合两种菌株中VapBC5基因结构的相似性,作者推断Mab VapBC5系统很可能是具有活性和功能的TA系统。
为验证假设是否成立,作者在Mab标准菌ATCC 19977(不含TA系统)中构建了VapB5和VapC5的外源表达系统。结果显示,低水平诱导表达毒素蛋白VapC5即抑制细菌生长,而VapC5与抗毒素蛋白VapB5共表达则使细菌生长状态恢复(图1 BC),毒素蛋白VapC5在诱导表达4 h后就对细菌产生了明显的生长抑制(图1 D)。这些结果证明了Mab VapBC5系统是一对有活性的TA系统。
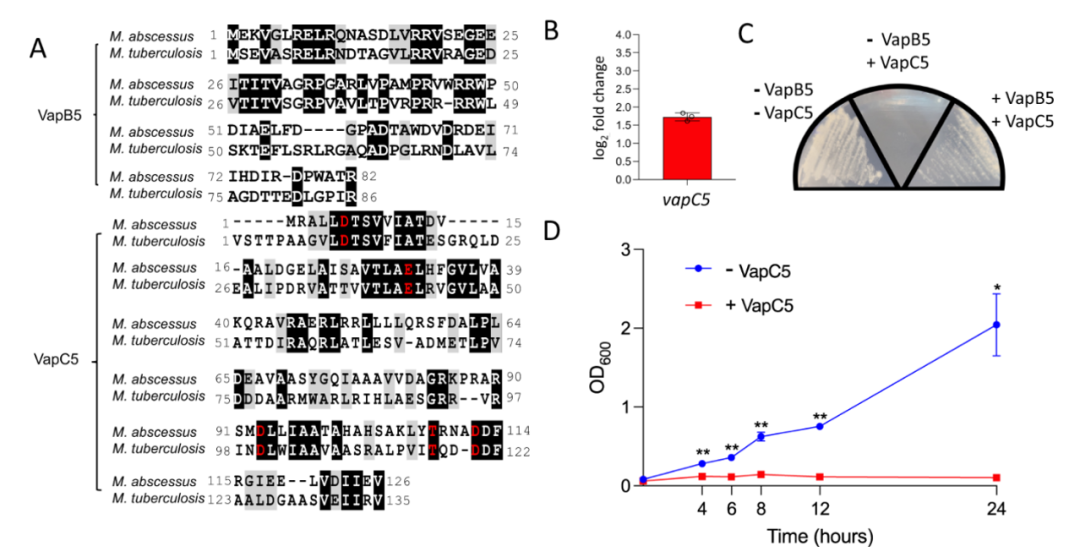
▲图1 Mab临床株VapBC5 TA系统的序列比对与功能验证
▼ 2.VapC5特异性切割tRNASerCGA和tRNAfMet
在结核分枝杆菌中,毒素蛋白VapC是结构、序列特异性的核糖核酸内切酶,主要切割特定tRNA反密码子环上的单一位点,使该tRNA失活。为探究Mab VapC5的靶标,作者采用了该团队自主研发的5’ RNA-seq技术,在单碱基分辨率下检测VapC5切割后的产物。结果显示,VapC5有两个tRNA靶标,分别是tRNASerCGA和tRNAfMet(图2 A),此结果也得到Northern Blots验证(图2 B)。VapC5切割tRNA的位点位于反密码子环,该特点与其他tRNA酶类毒素一致(图2 CD)。此外,VapC5对上述两种tRNA的切割位点都位于反密码子的第二、三位碱基之间。与其他VapC系列毒素不同的是,Mab VapC5有两个tRNA靶标,而其他已鉴定的VapC则只切割单一tRNA。
通过序列比对可知,Mab tRNASerCGA和tRNAfMet具有20个相同碱基,分布在tRNA L型三级结构的垂直臂上。根据结核分枝杆菌VapC蛋白与其tRNA靶标的分子对接结果,该垂直臂包含了VapC蛋白的结合位点,此结果表明VapC5对tRNA靶标的识别和结合具有序列和结构特异性。此外,根据其他研究报道,tRNA的核糖骨架以及转录后修饰也可能影响VapC5的识别和切割。
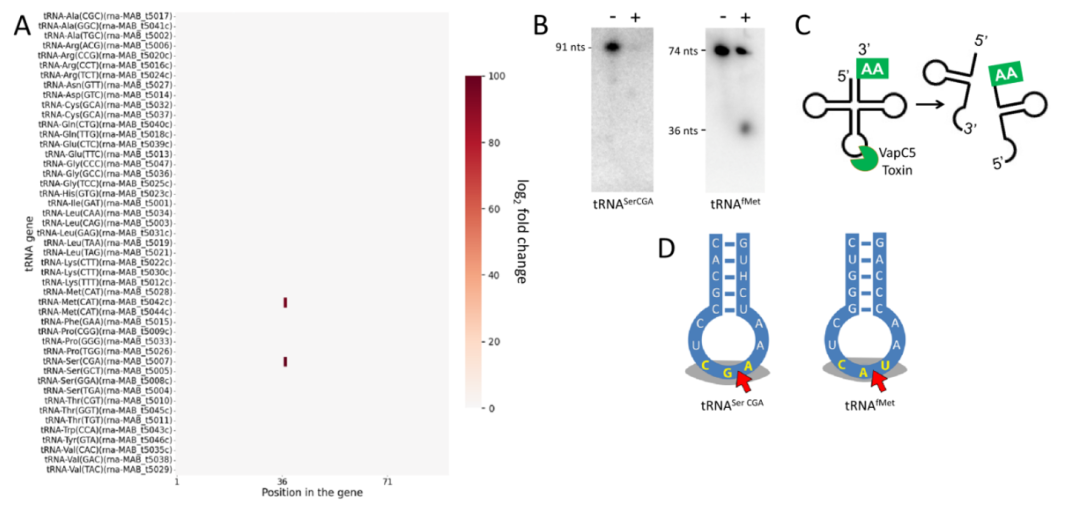
▲图2 VapC5切割两种tRNA的反密码子环
▼ 3.VapC5显著上调whiB7
作者团队采用全基因组范围的RNA-seq寻找VapC5表达情况下的差异基因,结果显示whiB7基因的表达提升最为显著(图3 A)。WhiB7促进核糖体甲基转移酶Erm(41)的产生,使得Mab对大环内酯类药物耐药。同时,WhiB7也会促进Gcn2相关N-乙酰转移酶基因eis2、氨基糖苷乙酰转移酶基因aac(2’)和外排泵基因tap的表达,相关结果也得到qPCR验证(图3 B)。
为进一步分析VapC5引起的转录组变化,作者使用了一个高通量整合数据挖掘平台——DAVID注释系统。如图3 C所示,VapC5引起的下调基因主要集中在“物质转运”和“能量代谢”,此结果与VapC5造成细菌生长抑制的现象相对应。同时,“哺乳动物细胞侵入”相关基因也受到抑制,提示VapC5对Mab的生长周期或感染进程也有影响。VapC5表达引起的上调基因只有“核糖体蛋白”组(图3 D)。
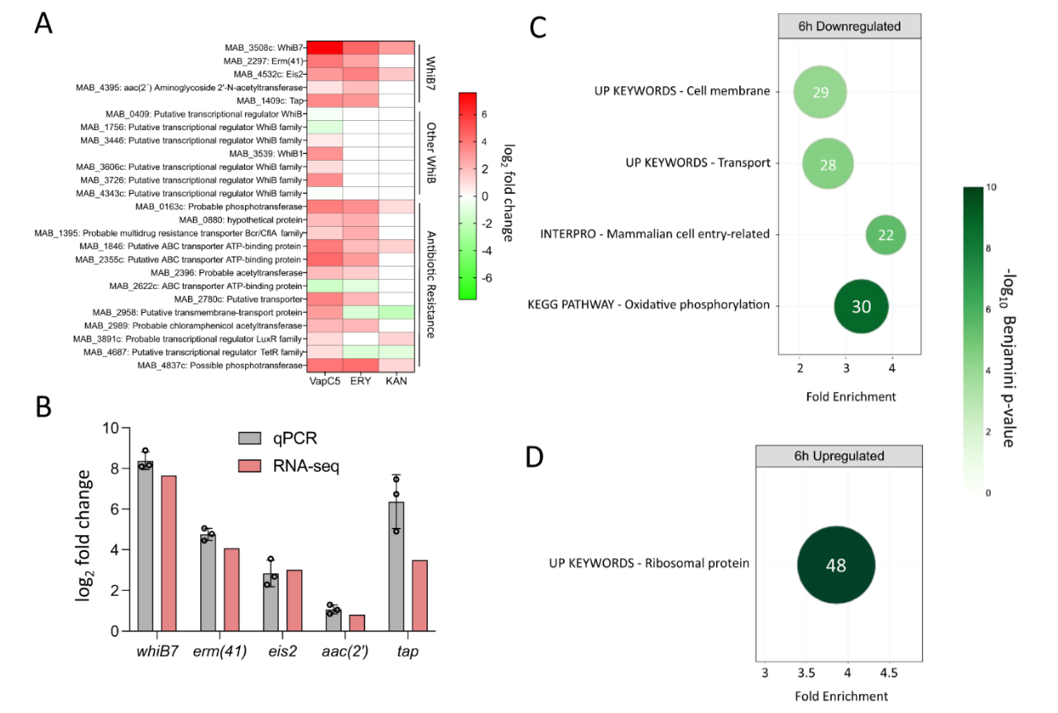
▲图3 VapC5介导WhiB7、核糖体蛋白和多种抗生素应答基因的表达
▼ 4.VapC5使核糖体大量囤积
为深入探究VapC5对Mab产生的影响,作者进一步采用蛋白组学技术,定量分析VapC5表达的第8、10和14小时后Mab蛋白组的变化(图4 A-C)。结果显示,VapC5的表达引起多种蛋白丰度变化。DAVID注释结果显示,下调蛋白的分类主要集中在“肽聚糖合成”、“DNA复制”和“能量代谢”,同样与细菌生长抑制的表型相对应。
虽然VapC5抑制Mab生长,但其表达仍引起多种蛋白含量提高(图4 D-F)。DAVID结果显示,上调蛋白主要为“核糖体蛋白”及其他相关的功能分类。此外,蛋白质合成相关蛋白的含量也有所提高,包括翻译起始因子IF-1、IF-2、IF-3与翻译延伸因子EF-Tu、EF-Ts、EF-G、EF-P等,分类于“蛋白生物合成”或“细胞质”中(图4 D)。在“分子伴侣”分类中,GroEL、GroES、触发因子、DnaJ1与DnaJ2的含量显著上调(图4 E)。分子伴侣蛋白在核糖体组装和蛋白合成等方面起到重要作用,因此该类蛋白表达上调符合预期。由于多种分子伴侣参与到rRNA的成熟过程,因此也被分类到图4 E中的“RNA降解”中。若VapC5的诱导时间达到14小时,仍仅有核糖体蛋白含量显著提高(图4 F)。此结果也与转录组测序结果相对应,VapC5表达促进大量核糖体蛋白编码基因的转录,进而使核糖体蛋白丰度显著提高(图4 G)。
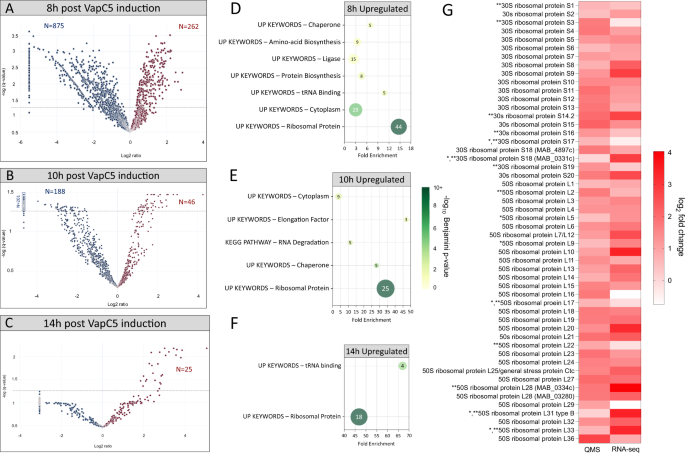
▲图4 VapC5促进核糖体蛋白的合成
▼ 5. tRNASerCGA的短缺引发密码子依赖性的蛋白组重塑
为探究VapC5切割tRNASerCGA引起核糖体蛋白大量表达的原因,作者首先关注了tRNA短缺引发的核糖体停滞。在翻译延伸过程中,由于大量tRNASerCGA被VapC5切割失活,当核糖体A位点运动到丝氨酸UCG密码时便会停滞。此时细菌内源的RNA酶将会切割无法翻译的mRNA,而核糖体覆盖的约15个核苷酸无法被切割(图5 F)。因此,本文的5’ RNA-seq方法可以检测核糖体停滞的现象。如图5 A所示,绿色标记的碱基即为5’ RNA-seq检测到的第一位碱基,位于红色标记的UCG密码子上游约15 nt。作者也使用了kpLogo工具绘制了截断的mRNA与其编码氨基酸序列的权重图,同样证明了上述观点(图5 BC)。此现象也在耻垢分枝杆菌中具有一定的保守性(图5 DE)。细胞中可用的核糖体丰度降低是一个危险的信号。为了维持细胞中核糖体的丰度,细菌在生长抑制的状态下仍然启动了核糖体蛋白表达通路,引起细胞中核糖体蛋白含量提高。
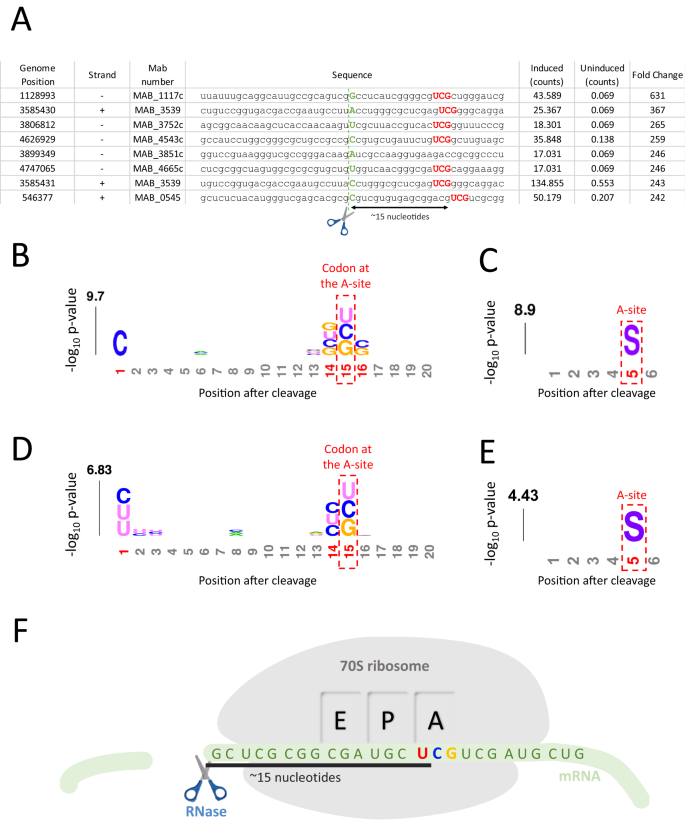
▲图5 VapC5引起的tRNASerCGA短缺使核糖体在丝氨酸UCG密码子处停滞
核糖体在mRNA的UCG密码处停滞,将产生截断并且无功能的mRNA,这类mRNA编码的蛋白丰度也势必会下降。蛋白组数据也证实了这一点,结果显示,下调的蛋白普遍包含更多的UCG密码子(图6 AB),而核糖体蛋白包含的UCG密码子更少(图6 B)。将转录组、蛋白组和UCG密码子含量一同比较,也可发现VapC5使UCG密码子含量高的蛋白及其相应mRNA的丰度降低,引起了全局性的蛋白组重塑(图7)。
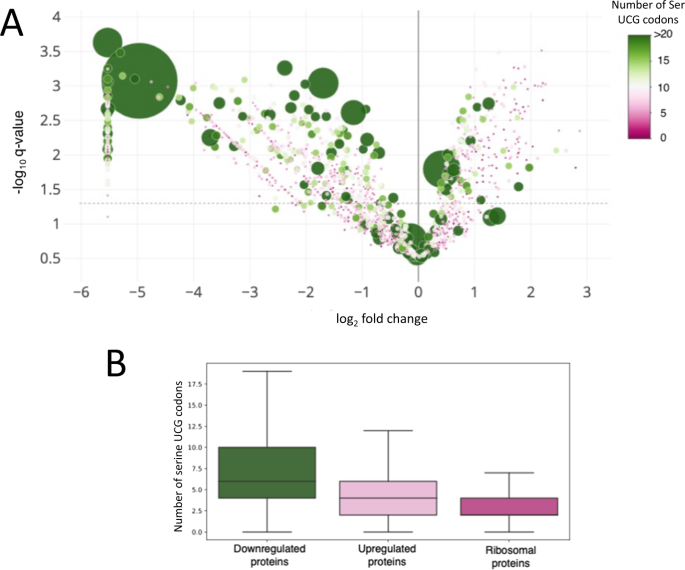
▲图6 VapC5引起密码子依赖性的翻译变化
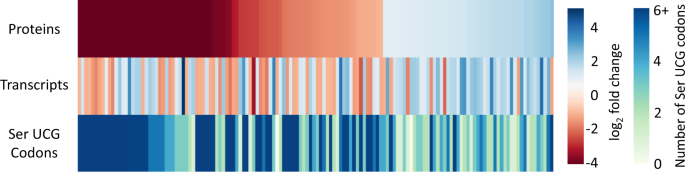
▲图7 表达VapC5的Mab中mRNA和蛋白丰度的相关性
▼ 6. VapC5促进持留菌的形成
蛋白组学反映的变化为解析VapC5如何影响Mab在抗菌药物处理下的存活提供了线索。氨基糖苷类抗菌药物阿米卡星和头孢菌素类药物头孢西丁是临床治疗Mab感染的一线药物,而VapC5的表达提高了Mab在10×MIC浓度的阿米卡星或头孢西丁压力下的存活能力(图8 A-D)。除此之外,特地唑胺也是治疗Mab的可选药物,VapC5同样可以促进Mab在特地唑胺压力下的持留(图8 EF)。可见当Mab表达VapC5时,阿米卡星、头孢西丁和特地唑胺的杀伤能力都被减弱,Mab持留菌更易形成。VapC5作为毒素蛋白使细菌分裂速率降低,使头孢西丁等靶向生长细胞的抗菌药物效果下降,而其介导的核糖体蛋白含量提升则使阿米卡星、特地唑胺等靶向细菌核糖体的药物失效。此效果并非来源于细菌获得耐药基因或药物作用靶点发生突变,而是仅来源于TA系统中毒素蛋白的激活。
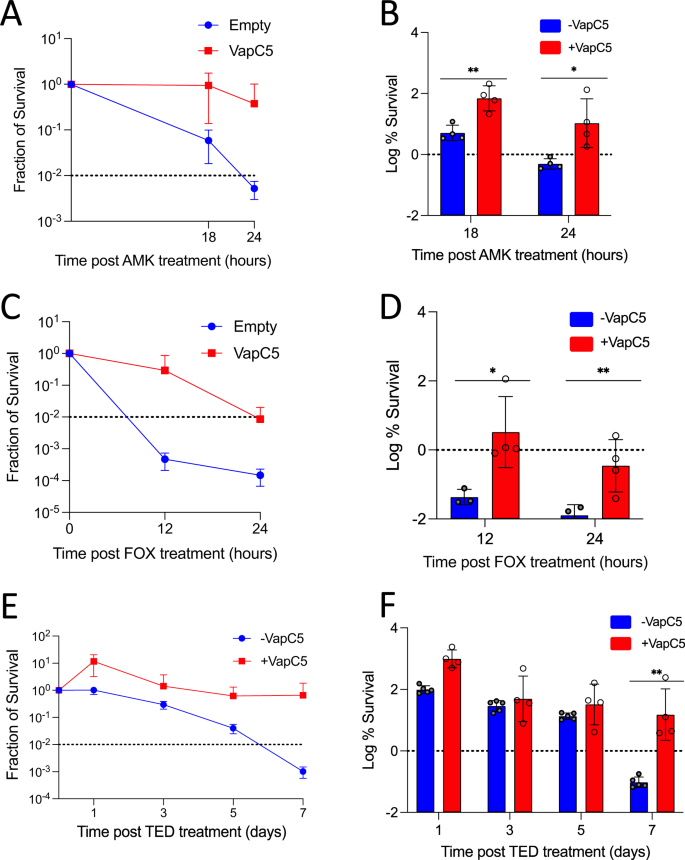
▲图8 VapC5赋予Mab固有耐药
综上,本文证明了Mab Ⅱ型TA系统中的毒素蛋白VapC5的主要功能是切割tRNASerCGA,使其失活,导致细菌生长抑制的同时引发一系列转录组变化和蛋白组重塑,使核糖体及蛋白翻译所需的其他因子超量合成。最终导致以下结果:1.头孢西丁等靶向生长细胞的抗菌药物的疗效降低;2.大量储备的核糖体与翻译因子使靶向核糖体的抗菌药物失效;3.激活WhiB7因子,进而激活多种耐药基因,使Mab在药物压力下得以存活,导致临床治疗失败。
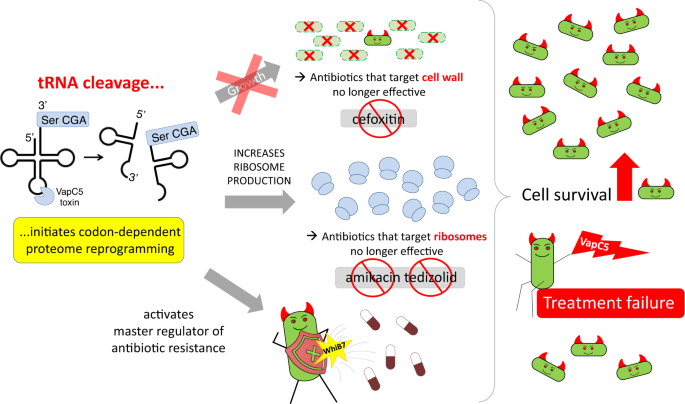
▲图9 Mab VapC5毒素激活多条耐药通路,使一线抗菌药物失效
▲点击图片,关注2023京港年会

高源
中国农业大学动物医学院,博士研究生
END
作者|高源(中国农业大学动物医学院)
审校|汪洋(中国农业大学动物医学院)


