2023-11-02 17:20
作者 潘姿彤

京港感染论坛
多学科合作,构建诊断管理体系

鲍曼不动杆菌是一种常见的医院获得性病原体,主要导致呼吸机相关性肺炎和菌血症。尽管鲍曼不动杆菌缺乏鞭毛,但它具有一种还未明确特征的与表面相关的运动性,与其生物膜形成和抗干燥特性一起被认为是促进其环境持久性的因素。1,3-二氨基丙烷(1,3-diaminopropane,1,3-DAP)是鲍曼不动杆菌特异性产生的带正电荷的代谢物,它与细菌运动和毒力有关,但其调节运动性的机制尚未明确。细菌中大多产生多胺乙酰转移酶SpeG(亚精胺乙酰转移酶,Spermidine acetyltransferase)对多胺水平进行调控,而不动杆菌属不产生任何常见的细菌多胺,也不编码SpeG同源物,所以它一定存在一种调节1,3-DAP的替代机制。
本文研究团队发现了一种鲍曼不动杆菌编码的新型GNAT家族(Gcn5-related N-acetyltransferase)乙酰转移酶Dpa(diamino-propane acetyltransferase),能够通过乙酰化1,3-DAP使细菌运动性下降,其对DAP的乙酰化修饰在非生物表面的生物膜形成、感染期间与真核细胞的粘附中都有重要作用。研究团队通过对Dpa结构的观察也发现,与细菌SpeG相比,其结构及功能更接近真核多胺乙酰转移酶SSAT(亚精胺/精胺N-乙酰转移酶,Spermidine/Spermine N-acetyltransaferase)。该文章于2023年6月发表在《nature communications》杂志,标题为《A polyamine acetyltransferase regulates the motility and biofilm formation of Acinetobacter baumannii》,本文主要研究发现如下:
![]()
▼ 一、Dpa可调控生物膜形成和细菌运动性
大肠埃希菌和志贺氏菌通过对多胺进行乙酰化修饰,将其转化为惰性形式以调控其水平,因此研究团队在不动杆菌属中寻找可以发挥同样功能的乙酰转移酶,但并未检索到任何与已表征良好的细菌多胺乙酰转移酶SpeG的同源候选酶。进一步在不动杆菌的假定蛋白中进行比对,发现了与细菌及真核乙酰转移酶具有遥远但显著同源性的Dpa。
接下来研究选择可以进行抽搐运动的分离株构建dpa基因敲除株,评估其通过调节1,3-DAP水平进而调控细菌运动的作用。结果显示,与野生型细菌相比,缺失突变株在半液体琼脂中能够进一步迁移,这表明dpa表达可以抑制细菌的抽搐运动。此外,生物膜的形成本质上与细菌运动有关,因为它需要进行游离和粘附定植之间的转换。研究结果显示,dpa缺失对生物膜形成的影响与细菌运动性相反,突变细菌形成的生物膜较少,而质粒中dpa基因的表达可以抵消这种影响。同时,dpa在固定相及生物膜中的表达活跃,在粘附细菌中的表达也要高于游离细菌。以上结果都说明,细菌运动和生物膜形成的调节与Dpa的活性之间存在直接联系。
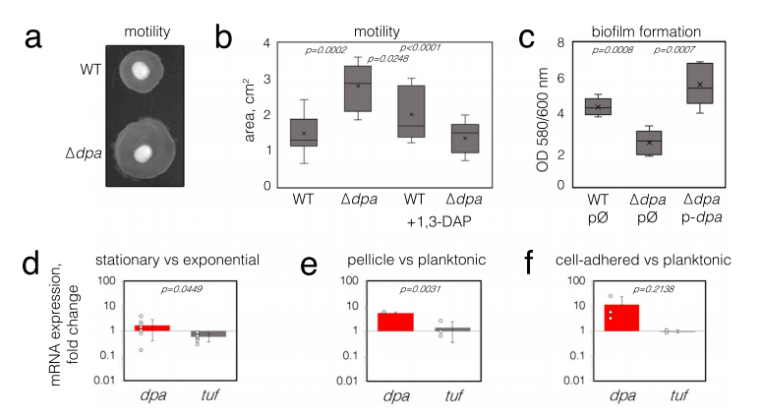
▲图1 dpa对细胞运动和生物膜形成的影响
▼ 二、Dpa特异性针对鲍曼不动杆菌,并且1,3-DAP是Dpa的主要底物
研究人员接下来进行对Dpa底物的检测,首先使用乙酰辅酶A ([14 C]acetyl-Coenzyme A,[14 C]acCoA)作为乙酰供体,对敲除了dpa的鲍曼不动杆菌提取物进行乙酰化,在蛋白质和核酸中没有发现乙酰化信号,表明大分子并不是Dpa的靶点。然后研究人员过滤出分子量小于3 kDa的小分子,薄层层析显示小分子滤液与[14 C]acCoA和Dpa酶共同孵育后出现乙酰化条带,因此确定了Dpa的底物主要是小分子,并且在大肠埃希菌中并没有形成该条带,这表明Dpa的低分子量靶点存在于鲍曼不动杆菌中,而在大肠埃希菌中不存在。接下来对多种小分子多胺进行乙酰化分析并比对,发现1,3-DAP是Dpa酶的特异性靶点。由于多胺浓度所导致的pH变化会对酶活性造成影响,研究发现在未缓冲条件下,Dpa会将1,3-DAP转化为乙酰二氨基丙烷以快速调节其水平,但将N-(3-氨基丙基)-乙酰胺(单乙酰化的1,3-DAP)作为底物时发现其作用效果较差,说明单乙酰化的DAP是该酶促反应的主要产物,而双乙酰化产物不是。对Dpa底物的特异性范围进行表征,也表明其他乙酰转移酶靶向1,3-DAP的效果较差。
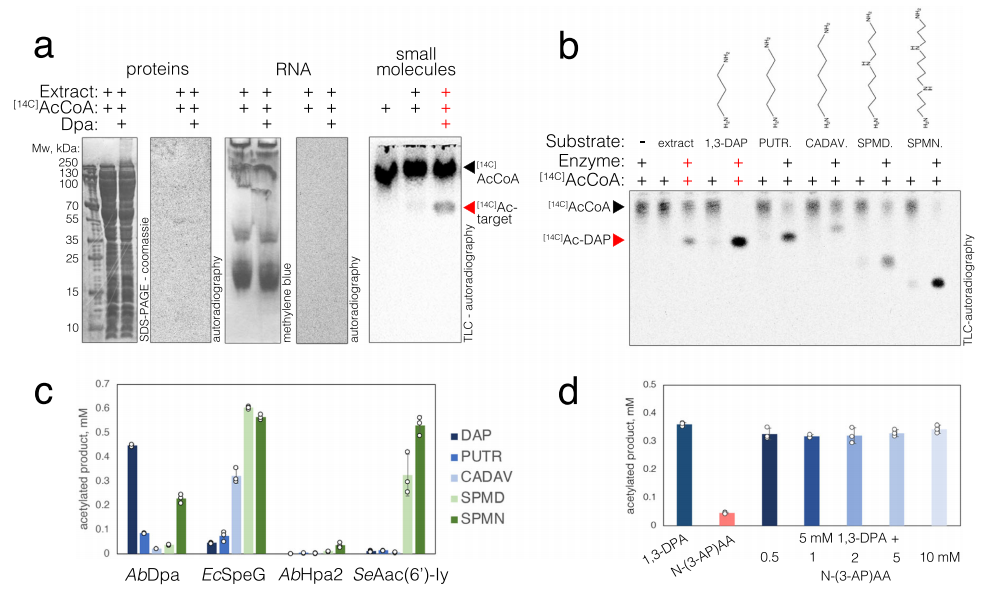
▲图2 检测Dpa酶的底物
▼ 三、Dpa结构是一个β链交换的二聚体,与真核生物中的活性位点取向类似
通过确定Dpa与acCoA结合状态下的结构发现,Dpa具有与GNAT家族乙酰转移酶相同的整体拓扑结构,形成了通过C端β链交换的二聚体,这种结构在溶液中很稳定。β链的交换形成了一个暴露在溶剂中带负电荷的β桶状通道,可以将酶和acCoA的乙酰基部分与整体溶剂连接起来,同时β-桶的酸性性质也促进了碱性多胺进入反应中心。由于该通道靠近收缩的反应中心,其较小的尺寸也对小分子1,3-DAP多胺的特异性有所影响。Y128是Dpa的和acCoA结合的活性位点残基,构建携带Y128F突变的催化受损的Dpa酶,观察其与acCoA和DAP结合前后的状态,发现在催化反应前后没有发生主要结构的重排,这与多胺浓度增加会导致结构改变的SpeG不同。并且发现DAP的活性位点取向与小鼠中SSAT相似,说明这些亚家族在功能上是具有相关性的。在Dpa的酸性活性中心,金属离子与D80、D81进行配位抑制活性位点负电荷,以此将水分子网络连接起来并容纳多胺底物。同时金属离子与D80、D81的配位具有拉力效应并由此产生一个β-凸起,这个β-凸起能够决定底物结合位点并使辅酶的乙酰基找到稳定方向。
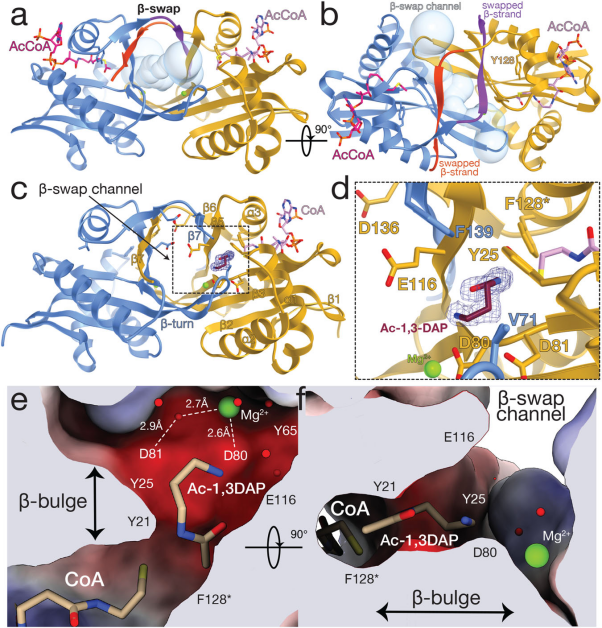
▲图3 Dpa酶的结构及其底物结合特性
▼ 四、Dpa结构与真核乙酰转移酶Hpa2和SSAT具有相关性
Dpa在结构上具有与小鼠和人类C端β链交换二聚体相同的四级排列,该结构也可见于酵母菌Hpa2(组蛋白乙酰转移酶,Histone acetyltransferase)和肠炎沙门氏菌Aac(6‘)-Iy。而SpeG十二聚体是由6个二聚体单元通过与Dpa相似的连接组成的,但没有发生β链的交换。所有这些酶的单体都可以通过中心的β-桶和四个主要的α-螺旋来排列,GNAT酶的最后一条β链即β7结构在所有多胺乙酰转移酶中都是保守的,不同的是,其在Dpa中与β5和β6之间的蛋白质分离,而在SpeGs、鲍曼不动杆菌AbHpa2和枯草芽孢杆菌属植物亚精胺-亚精胺乙酰转移酶BsPaiA中β7插入到β6和β5之间。多胺乙酰转移酶的主要拓扑差异是由β链β3和β4之间的β-转角决定的,它决定了两个单体间的距离,并构成了底物进入通道的底部。在SpeGs、AbHpa2和BsPaiA中,这个β-转角是向内扭曲的,相比之下,在Dpa和其他二聚体GNATs中,β-转角一直延伸到C端的β链交换处,共同形成中心通道的入口。
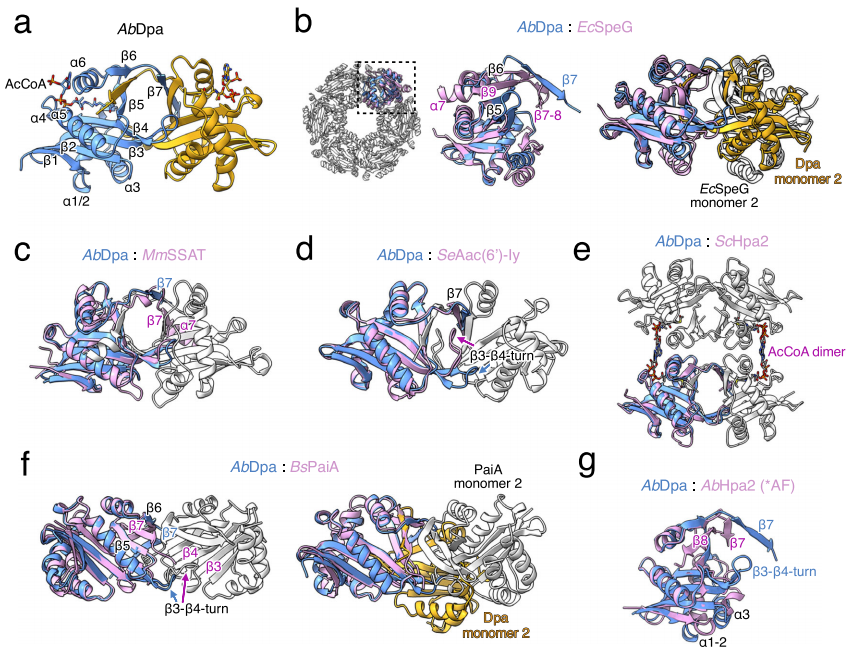
▲图4 细菌和真核生物多胺乙酰转移酶的比较
▼ 五、Dpa与其他多胺乙酰转移酶底物结合特性有相似性
Dpa、小鼠SSAT和霍乱弧菌SpeG的底物结合结构表明,多胺乙酰转移酶都是通过其酸性口袋结合底物的。多胺通过Dpa和SSATs的酸性β桶通道进入反应活性中心,而在SpeG中,带负电荷的残基大多位于β3和β4链上,以及α-螺旋α2或α3的内侧,因此在环状的SpeGs中,多胺通过十二聚体的中心负电荷孔进入。总的来说,除了与磷酸腺苷基团的配合外,所有GNAT家族中与辅酶A的结合都是相似的。在SpeG和SSAT中,碱基由位于α4和α5之间高度保守的环状结构序列所协调,使磷酸基接触α6。相比之下,在Dpa、Aac(6’)-Iy和PaiA中,由于环状结构序列的差异,磷酸腺苷能够与α6完全对接,Dpa中较大的R90侧链也会对磷酸腺苷基团产生推动作用。总之,以上这些结果表明,Dpa是一种功能和结构上不同于其他细菌的多胺乙酰转移酶,其与真核多胺乙酰转移酶SSAT或Hpa2的相似性要高于与原核SpeG或PaiA的相似性。
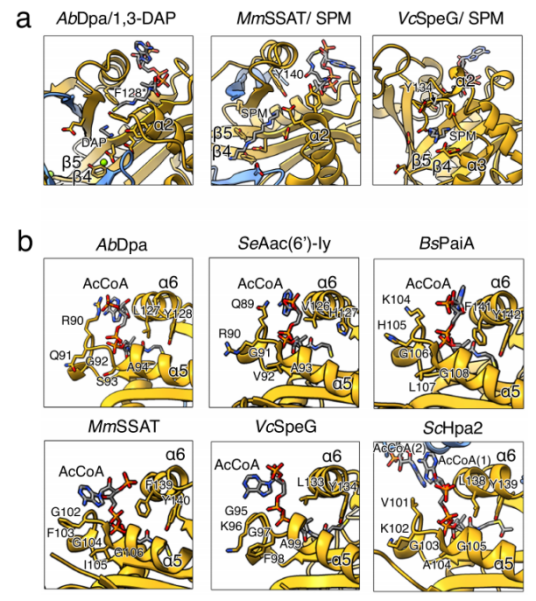
▲图5 在不同乙酰转移酶中多胺和乙酰辅酶A的结合特性
▼ 六、总结
鲍曼不动杆菌所产生的特异性多胺1,3-DAP由天冬氨酸半醛通过二氨基丁酸转氨酶(Dat)和2,4-二氨基丁酸脱羧酶(Ddc)这两种酶作用合成,能够对细菌运动和毒力产生影响。在该研究中,发现了该通路的下游调控元件多胺乙酰转移酶Dpa,可以特异性地乙酰化鲍曼不动杆菌1,3-DAP从而对细菌运动性进行调控,未来的研究还需要评估乙酰化的DAP作为一种潜在的信号分子的功能。同时,该研究表明,1,3-DAP的乙酰化在非生物表面的生物膜形成和在真核上皮细胞的粘附中都起着重要的作用。因此,Dpa可能成为开发新型高特异性抗菌药物以对抗多重耐药鲍曼不动杆菌传播的合适靶点。
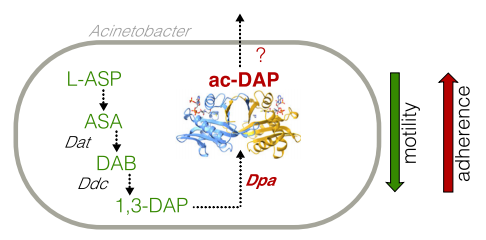
▲图6 Dpa酶在鲍曼不动杆菌中的作用

潘姿彤
北京大学人民医院2023级硕士研究生
END
作者|潘姿彤(北京大学人民医院)
审校|李荷楠(北京大学人民医院)

