2019-01-19 23:03
作者

前言部分
翻译:余霞(重庆市丰都县人民医院科教科)
审校:李婷(山西省运城市中心医院)
宁永忠(清华大学附属垂杨柳医院)
附录H的缩写AST
抗微生物药物敏感性试验(余注:参见中国行标WS/T 639-2018)
ESBL 超广谱β-内酰胺酶
KPC 肺炎克雷伯菌碳青霉烯酶(宁注:英文是Klebsiella pneumoniae carbapenemase。这个很容易误解。其实就是我们平时说的KPC酶,KP是用肺炎克雷伯菌来命名,但该酶不限于该菌。也就是说,大肠埃希菌可以产生“肺炎克雷伯菌碳青霉烯酶”——字面上有些矛盾)
MIC 最低抑菌浓度
MRSA甲氧西林耐药金黄色葡萄球菌
N/A 不适合
PBP2a 青霉素结合蛋白2a
VRE 万古霉素耐药肠球菌
本附录表格提供了一种实用的方式,用于检测和报告医学实验室的结果——常规使用分子技术(伴或不伴表型检测)来检测抗微生物药物的耐药性。抗微生物药物耐药性具有遗传复杂性,基于现有数据(宁按:指既有数据有限)。分子方法通常用作筛选工具(如,鼻拭子监测MRSA)或作为传统表型方法的快速辅助(如,仪器报警血培养瓶检测KPC)。结果的解释需要深入思考和理解确认“耐药”的标志物和表型“敏感”之间的动态变化。检测出耐药性标志物并不必然预测抗微生物药物的治疗失败。该基因可能无功能,或表达水平低,不具临床意义。相反,遗传标志物的缺乏不一定表示敏感,因为技术问题可能干扰检测(如,抑制扩增,出现遗传变异)。有时,分子检测可能优于传统的表型检测,例如体外表达水平低,异质性耐药或微生物生长不佳掩盖了高值MIC。总体而言,实验室人员应努力对分子技术采取一致性的方式,并通过复检或补充试验,转至参考实验室,或根据机构政策(institutional policies)同时报告结果,来解决结果不一致的情况。
随着对抗微生物药物耐药性的分子机制的认识不断发展,毫无疑问在医学微生物学实验室会出现更尖端的分子检测技术,用以检测抗微生物药物的耐药性。以下表格将根据需要进行更新,以确保随着技术的发展相关指南能够有所体现。

表H1 用分子生物学和AST方法检测金黄色葡萄球菌对甲氧西林(苯唑西林)结果的报告策略
翻译:刘泽世(西安交通大学第二附属医院)
吕春宝(辽宁省抚顺市中心医院)
审校:王晓玲(山西省中医院)
鲁炳怀(中日友好医院)
宁永忠(清华大学附属垂杨柳医院)
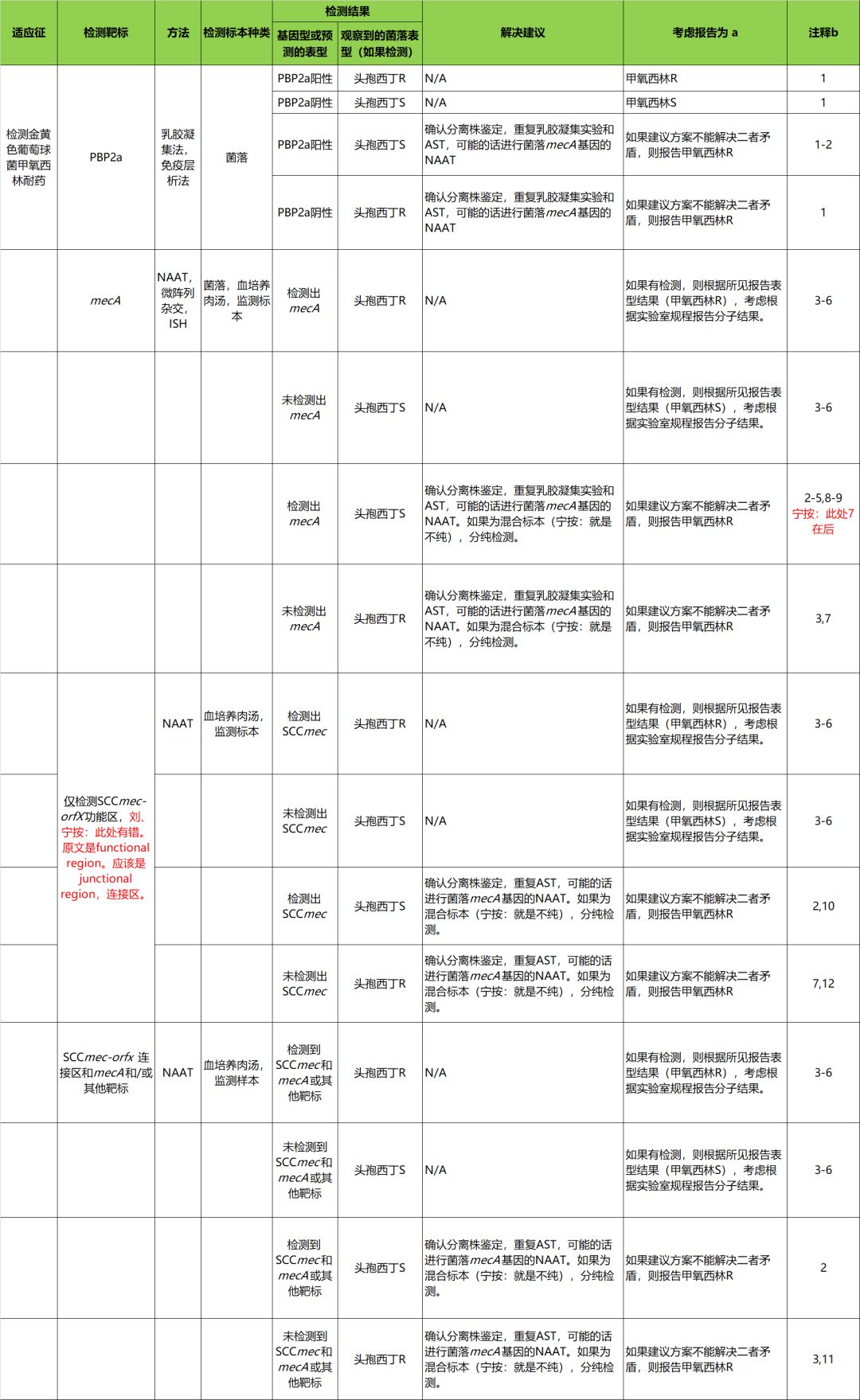
缩写:AST,抗微生物药物敏感性试验;CoNS,凝固酶阴性葡萄球菌;ISH,原位杂交;MSSA,甲氧西林敏感金黄色葡萄球菌;MRSA,耐甲氧西林的金黄色葡萄球菌;N/A,不适用;NAAT,核酸扩增试验;PBP2a,青霉素结合蛋白2a;PCR,聚合酶链反应;R,耐药;S,敏感
宁按:表中没有CoNS、MSSA、MRSA等缩写,下面评论里有。
评论
1)已观察到假阳性和假阴性的PBP2a胶乳凝集试验结果[1]。
2)罕有mecA阳性金黄色葡萄球菌株对头孢西丁测试敏感[2, 3]
3)mecA PCR不能检测到mecC或mecA变异基因介导的甲氧西林耐药[4, 5]。
4)mecA阳性的CoNS和MSSA的存在,可能导致MRSA分子结果假阳性[6, 7]。
5)携带不稳定SCCmec插入的菌株,在培养过程中可能丢失mecA[8]。
6)与培养法相比,分子方法的敏感性可能较高,特异性可能较低。
7)有报道,对直接血培养检测,偶尔有mecA假阴性[9]。
8)头孢西丁诱导步骤进行ISH检测,假阳性的mecA结果应该是罕见的[10]。
9)多微生物生长时,mecA的存在不能归于特定的分离株。
10)携带缺乏mecA基因(mecA丢失)的SCCmec残体的菌株或突变的mecA等位基因的菌株,可能只有SCCmec-orfX连接区靶标检测阳性。使用只检测SCCmec-orfX连接区靶标的分子方法的实验室,可以考虑在报告中添加一个免责声明,说明所服务患者群中分离出来的mecA信号丢失分离株相关假阳性结果的比例[11]。
11)存在多种SCCmec类型;根据试验设计,可能无法检测到一些SCCmec变体[12]。
脚注
a.测试甲氧西林耐药的菌株,也是苯唑西林耐药。术语“甲氧西林R”是“苯唑西林R”的同义词。
b.除了评论中所列的具体情况外,基因型和/或表型的差异,也可能由下列原因导致:次优抽样,混合生长,新基因型或突变的出现,和/或耐药靶标的野生型逆转(wild-type reversion)。
注意:黑体信息是对上一版的增改。(宁按:表H都是黑体)
宁按:野生型逆转(wild-type reversion),第一次看到。待方家教我。
表H1的引文:从略,详见原文p257。
审阅:王 辉 北京大学人民医院
胡志东 天津医科大学总医院


