2019-02-03 21:32
作者 宁永忠
第 4 卷,第 1 期,2019 年 1 月
第三部分
翻译:黄磊(北京大学第一医院)
审稿:宁永忠(垂杨柳医院)鲁炳怀(中日医院)
背景
近年来抗真菌药物使用不断增多,并且人们已经认识到真菌的某些种具有天然耐药性,或在治疗中会出现耐药性,因此对抗真菌药物敏感性试验(antifungal susceptibility testing,AFST)也有了更多需求。
1 AFST结果可用于:
•在某些特定的临床状态,例如念珠菌血症和粘膜念珠菌病,预测可能的结果,指导抗真菌治疗。2,3
•检测治疗过程中产生的耐药
•监测当地的敏感性模式(susceptibility pattern),以指导经验性治疗
尽管念珠菌属菌种是与侵袭性真菌感染相关的最流行的病原体,但它的每个种都有独特的潜在毒力、药敏谱、和流行病学特征。4值得注意的是,2009年首次报道的耳念珠菌,对主要抗真菌药物的敏感性都有所下降,已发展成为可快速传播、进而引起医院内暴发感染的原因之一,具有很高的病死率。5,6
2017年CLSI把肉汤法和纸片法的药敏试验文件进行合并,并把菌种特异性的MIC解释折点引入CLSI M60文件。7 该文件包括最常见念珠菌对特定药物的折点(棘白菌素、氟康唑、伏立康唑,见表1)。需注意CLSI M60文件并未包含所有念珠菌,而且也不是对所有进行检测的抗真菌药物都设置了折点。没有折点时,CLSI M59文件中的“流行病学界值(epidemiological cutoff value,ECV)”可用于警示基于MIC值的天然或获得性耐药可能性(见表1)。9 ECV是MIC值,推测可用于区分那些“有”和“没有”天然或获得性耐药特征菌株的群体。ECVs不能用于预测治疗的临床结局,而且药物敏感性的分类(例如,敏感 / 中介 / 剂量依赖敏感 / 耐药)不应与ECV同时报告。因为它未涉及临床、药效学和药代动力学的相关数据。然而,ECVs有助于检测出那些可能携带抗真菌药物耐药机制的菌株.(宁永忠按:此处引文8和9的标注,前后顺序反了)
美国感染病学会(Infectious Diseases Society of America,IDSA)和欧洲临床微生物与感染病学会(European Society of Clinical Microbiologyand Infectious Disease,ESCMID)推荐对所有临床相关的念珠菌分离株常规进行AFST抗真菌药物敏感性试验。 临床相关的分离株是那些分离自血液、身体其它无菌部位包括组织活检、骨和体液,例如脑脊液、腹腔积液、心包液、胸膜积液和关节液。2,3 通常有正常菌群定植的部位,例如呼吸道、胃肠道、阴道或皮肤,分离的念珠菌不应认为临床相关,故这些部位的分离株在通常情况下不常规进行药敏试验。
本文阐述CLSI已设置折点或有ECV推荐的念珠菌药敏试验。CLSI也给出了隐球菌的ECVs,但本文未包括该试验。CLSI也正在评估对耳念珠菌设置一些抗真菌药物折点的可能性,但目前还没完成。因此耳念珠菌的药敏试验会在将来的文章中讨论。
基于已发表的CLSI折点、ECVs和文献综述,表2包含对何时该做AFST的专家意见指南,表3建议了根据不同念珠菌种的一线和二线抗真菌药物敏感性试验的组合,也参考了发表于一系列杂志的专家意见。7,8,9,10 在很多情况下,决定是否要做抗真菌药物敏感性试验必须基于个体具体分析,并听取微生物学工作者、感染科医生和其他医疗提供者的意见。
对临床微生物学工作者可能遇到的有关抗真菌药物敏感性试验的几个例子,评论如下。
1. 从血培养中分离的光滑念珠菌
讨论:所有分离自血液的念珠菌都应常规进行AFST,药物至少应包含氟康唑。在这种情况下,光滑念珠菌通常对唑类药物获得性耐药,因此引起大家的特殊兴趣。1 应报告氟康唑的MIC值及其敏感性判断结果,也推荐同时检测棘白菌素。2,3 由于目前还没有光滑念珠菌对伏立康唑和泊沙康唑的临床折点,如果临床要求报告这些药物,实验室可考虑报告。9 也可检测两性霉素B的敏感性,并报告其ECV。
2. 从尿液标本中分离的克柔念珠菌
讨论:如果念珠菌的某些种分离自尿液,并证实其与泌尿系感染相关,则鉴定到种后不必进一步检查。如果需要治疗,通常会使用氟康唑。棘白菌素由于其药物活性成分很少分泌入尿液,故不用于治疗泌尿系感染。2如果氟康唑的敏感性不能通过对念珠菌鉴定到“种”来推测,例如光滑念珠菌通常对氟康唑获得性耐药,则可进行AFST。如果分离到对氟康唑天然耐药的克柔念珠菌,则可检测泊沙康唑或两性霉素B的敏感性(见表3)。克柔念珠菌对泊沙康唑和两性霉素B有ECVs(表1)。
3. 从口咽部标本分离的白念珠菌
讨论:粘膜念珠菌病在免疫低下患者中常见,这些患者通常已接受抗真菌预防用药。在这些免疫低下患者中,可进行AFST。2此外当治疗失败时,或需要排除氟康唑耐药的分离株并确定其它药物的敏感性时,推荐进行AFST。2,11
4. 从阴道标本中分离的白念珠菌
讨论:白念珠菌可定植在健康人的皮肤、粘膜表面和生殖道中。因为大约10%-20%的女性在阴道中可携带念珠菌的某些种和其它酵母菌,在没有感染症状或体征时,通过培养方法鉴定出的念珠菌是不需要治疗的。然而酵母菌培养仍是诊断女性外阴阴道念珠菌病的“金标准”。当临床已确诊女性外阴阴道念珠菌病而需要治疗时,局部经验性抗真菌治疗的典型方案包含一种唑类药物或口服氟康唑。总体而言,唑类药物敏感性试验不用于指导个体治疗,但在治疗复杂性外阴阴道念珠菌病时,可进行氟康唑的药敏试验。2,12
5. 从气管吸出物标本中分离的热带念珠菌
讨论:从呼吸道分离到念珠菌是入住ICU患者经常遇到的情况,这些患者通常是气管插管或长期气管切开。这几乎总是反映了气道定植而非感染。热带念珠菌具有显著的在医疗器械上形成生物膜的能力。因此对气管吸出物中分离到的热带念珠菌不需要进行AFST。2,13
总之,实验室对是否需要进行AFST以及对哪种抗真菌药物进行AFST应有清晰的操作流程。选择性地进行AFST,并通常尽量把念珠菌鉴定到“种”水平,尤其是在难治性的侵袭性念珠菌病例中,已证实是有用的。8 此外也应定期进行流行病学统计,以确定当地的敏感谱(susceptibility profile)和每个中心的耐药率。3 最后,用AFST来检测新发耐药和预测新药的潜在治疗效果,对医学持续进步具有重要意义。
表1. CLSI文件中发布的念珠菌对抗真菌药物的临床折点或ECVs
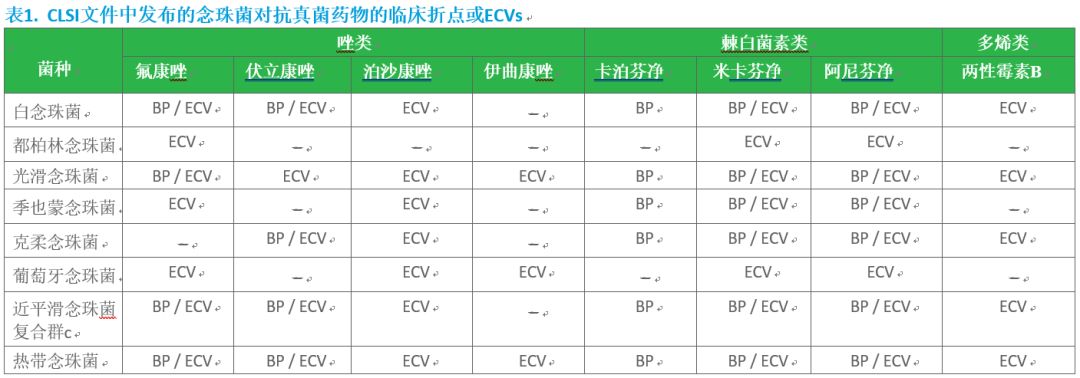
缩写:BP,临床折点;ECV,流行病学界值
a CLSIM60
b CLSIM59(黄磊按:上表没有找到a和b的标注)
c 用于近平滑念珠菌复合群的ECV,也适用于拟平滑念珠菌(C. orthopsilosis)和似平滑念珠菌(C. metapsilosis)。
表2. 根据样本来源对念珠菌抗真菌药物敏感性试验的推荐(引自Pfaller和Diekema10,Pfaller8)

注释:推荐监测当地的敏感谱(susceptibility profiles),并发布抗真菌药物谱(antifungal antibiogram)。
(宁永忠按:上表第6行第1列,把痰列在上呼吸道标本,可见国外对该标本的认识与定位)
(宁永忠按:注释的原文是“Monitoringlocal susceptibility profiles with an antifungal antibiogram is recommended”。两个词组susceptibility profiles和antifungal antibiogram一同出现。注意,从药物出发的是抗菌谱/杀菌谱/抑菌谱。从菌出发的是敏感谱(susceptibility profiles)、抗生素谱(antibiogram),累积形成的是敏感模式(susceptibility pattern)。要区分二者,本文件指的是后者,就是药敏试验报告及其累积数据)
表3. 基于CLSI文件7,8、Pfaller and Diekema10 和Pfaller8文献,针对念珠菌菌种,建议的一线和二线抗念珠菌药物的药敏试验组合
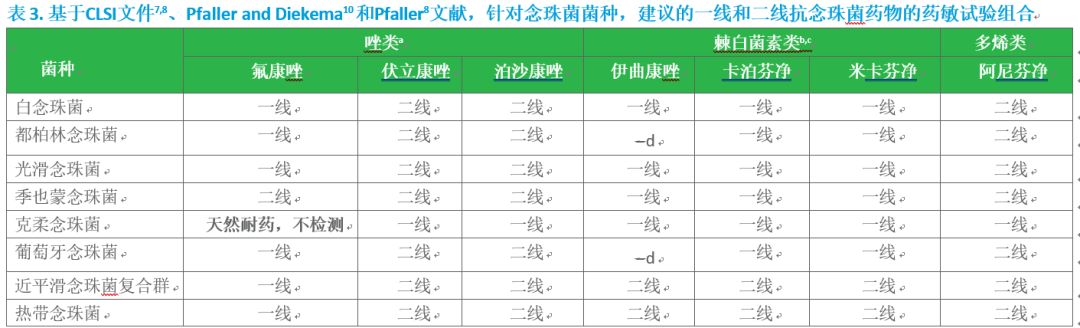
a 伊曲康唑通常对治疗念珠菌引起的感染在临床上是无益的(not generally clinically useful),因此没有包含在这个表格中。(宁永忠按:美国伊曲康唑,只用于浅部黏膜[口咽部、食管、阴道]感染。国内实际有深部应用)
b 至少检测一种棘白菌素类药物。
c 不要检测尿液分离株对棘白菌素的敏感性。
d 没有CLSI发布的临床折点或ECV。
注释:如果临床有需要,也可以进行其它抗真菌药物的敏感性试验。
参考文献
1Pfaller MA, Castanheira M, Lockhart SR, Ahlquist AM, Messer SA, Jones RN. Frequency of decreased susceptibility and resistance to echinocandins among fluconazole-resistant bloodstream isolates of Candida glabrata. J Clin Microbiol. 2012;50(4):1199-1203.
2Pappas PG, Kauffman CA, Andes DR, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America. Clin Infect Dis. 2016;62(4):e1-50.
3Cuenca-Estrella M, Verweij PE, Arendrup MC, et al. ESCMID guideline for the diagnosis and management of Candida diseases 2012: diagnostic procedures. Clin Microbiol Infect. 2012;18 Suppl 7:9-18.
4Pfaller MA, Moet GJ, Messer SA, Jones RN, Castanheira M. Geographic variations in species distribution and echinocandin and azole antifungal resistance rates among Candida bloodstream infection isolates: Report from the SENTRY Antimicrobial Surveillance Program (2008 to 2009). J Clin Microbiol. 2011;49(1):396-399.
5Pappas PG, Lionakis MS, Arendrup MC, Ostrosky-Zeichner L, Kullberg BJ. Invasive candidiasis. Nat Rev Dis Primers. 2018;4:18026.
6Lockhart SR, Etienne KA, Vallabhaneni S, et al. Simultaneous emergence of multidrug-resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses. Clin Infect Dis. 2017;64(2):134-140.
7CLSI. Performance standards for antifungal susceptibility testing of yeasts. 1st ed. CLSI supplement M60. Wayne, PA: Clinical and Laboratory Standards Institute; 2017.
8Pfaller MA. Invasive fungal infections and approaches to their diagnosis. In: Sails A, Tang Y, eds. Methods in Microbiology. Vol 72. Oxford: Academic Press; 2015:219-287.
9CLSI. Epidemiological cutoff values for antifungal susceptibility testing. 2nd ed. CLSI supplement M59. Wayne, PA: Clinical and Laboratory Standards Institute; 2018.
10Pfaller MA, Diekema DJ. Progress in antifungal susceptibility testing of Candida spp. by use of Clinical and Laboratory Standards Institute broth microdilution methods, 2010 to 2012. J Clin Microbiol. 2012;50(9):2846-2856.
11Patel PK, Erlandsen JE, Kirkpatrick WR, et al. The changing epidemiology of oropharyngeal candidiasis in patients with HIV/ AIDS in the era of antiretroviral therapy. AIDS Res Treat. 2012;2012:262471.
12Workowski KA, Bolan GA, Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recommendations and reports: Morbidity and mortality weekly report Recommendations and reports/Centers for Disease Control. 2015;64(RR-03):1-137.
13Negri M, Silva S, Henriques M, Oliveira R. Insights into Candida tropicalis nosocomial infections and virulence factors.Eur J Clin Microbiol Infect Dis. 2012;31(7):1399-1412.



