2019-04-26 14:22
作者 杨信怡

陈虹彤 李国庆 游雪甫* 杨信怡*
(中国医学科学院 北京协和医学院 医药生物技术研究所,抗感染药物研究北京市重点实验室,北京100050)
摘要:Plazomicin是美国Achaogen公司开发的新一代氨基糖苷类药物,商品名Zemdri,近期在美国经FDA批准用于肠杆菌科细菌引起,且其他药物治疗无效的尿路感染患者及急性肾盂肾炎患者的治疗。研究显示,Plazomicin抗菌谱广,对多数病原菌中携带的氨基糖苷类修饰酶有良好稳定性,血浆蛋白结合率低,与人体主要肝药酶无相互作用。治疗剂量下,Plazomicin对受治感染病例的临床疗效不劣于美罗培南、黏菌素。常见不良反应为轻、中度恶心、呕吐、头晕、腹泻,停药后可恢复。
关键词:Plazomicin;药效学;药动学;临床疗效;不良反应


Plazomicin(ACHN-490)是由美国 Achaogen公司开发的新一代半合成氨基糖苷类抗生素(AGs),分子量(MW)592.68,母核为2-脱氧链霉胺,是Sisomicin(西索米星)结构衍生物[1]。Aggen等报道采用八步合成,在西索米星母核 1位和6位分别引入羟基-氨基丁酰基和羟乙基获得[2,3],药物的化学结构见图1。2018年6月,Plazomicin注射剂经美国食品药品监督管理局(FDA)批准上市,用于治疗成年人复杂性尿路感染(cUTI)及急性肾盂肾炎(AP)[4],注册商品名Zemdri。Plazomicin对多数氨基糖苷类修饰酶稳定,对包括碳青霉烯类耐药肠杆菌科细菌(CRE)在内的耐多药(MDR)革兰阴性菌引起的感染具有良好疗效。但其对携带16SrRNA甲基化酶如ArmA和RmtC的耐药菌株仍缺乏有效抗菌活性[5]。人体对该药耐受性良好,常见不良反应为轻、中度消化道和中枢神经反应。本文结合Plazomicin最新药理研究进展,重点从药物作用机制、体外抗菌活性、临床疗效、不良反应等方面作一综述,为抗感染研究领域医药工作者提供参考。
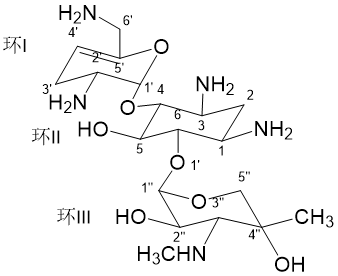
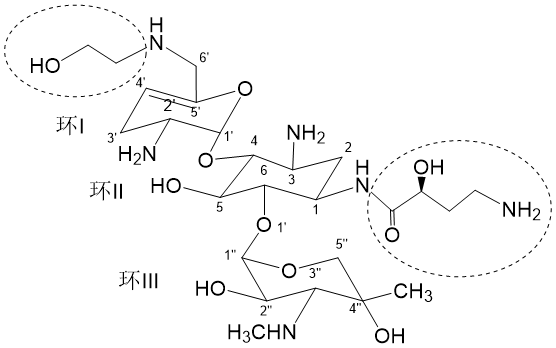
图1 西索米星(上)和Plazomicin(下)的化学结构



Plazomicin的构效关系研究显示,环Ⅱ(2-脱氧链霉胺环)上引入的4-氨基-2-羟基丁酰 (4-amino-2-hydroxybutyric acid,AHBA)侧链,有助于避免AAC(2′)(N-乙酰转移酶2′)的修饰作用。环I上,3、4位与西索米星相同,无羟基结构,使其可避免APH(3′)(O-磷酸转移酶3′)、ANT(4′)(O-核苷酸转移酶4′)的修饰。6′位引入 N-(2-羟乙基)可封闭AAC (6′)的作用位点。而环III上的甲基化修饰,也使药物能一定程度避免钝化酶AAC的修饰。另外,环I上引入的6′-N-(2-羟乙基)可增加药物对核糖体的选择性,但环Ⅱ上的AHBA起相反作用,故Plazomicin仍具有与西索米星、庆大霉素、妥布霉素等相似的耳毒性,这一点在实验动物中也得到了证明[6,7]。
同其他氨基糖苷类抗生素,Plazomicin主要通过与核糖体30S亚基16S rRNA解码区氨酰基-tRNA位点(A位点)的高度保守位点结合,干扰核糖体正常功能,使mRNA密码子误译并抑制易位,最终抑制蛋白质合成产生抗菌效应[8-10]。
针对Plazomicin(及其他氨基糖苷类抗生素),细菌可通过两种特殊方式导致高水平耐药,包括:1)产核糖体16S-rRNA甲基转移酶(16S rRNA mythylase);2)产氨基糖苷修饰酶(Aminoglycoside modifying enzymes,AMEs)。前者由质粒介导,携带armA和rmtB基因可编码甲基转移酶(AMT),分别对30S核糖体亚基16SrRNA上A位点的核苷酸G1405和A1408(AGs结合位点)进行甲基化修饰,使药物与A位点亲和力显著下降[11,12]。多数产新德里金属β-内酰胺酶-1(New-Delhi metallo-b-lactamase-1,NDM-1)的耐药菌的质粒上同时携带16S-rRNA甲基转移酶编码基因,故Plazomicin对这类细菌几乎无抗菌活性[13-15]。而AMEs则是由质粒或染色体移动原件介导,通过对氨基糖苷结构中发挥抗菌活性必需的氨基或羟基进行修饰(如乙酰化、磷酸化、羟基化修饰等),使药物与核糖体亲和力大大降低,从而介导氨基糖苷类抗生素耐药。药敏及体外酶学研究结果显示,大多数AMEs(如AAC(3')-Ia、AAC(3)-II等)不能修饰Plazomicin的结构,故对其抗菌活性无影响。Plazomicin对于携带AAC(6')-Ie-APH(2'')-Ia双功能酶从而对氨基糖苷类抗生素高水平耐药的金黄色葡萄球菌亦具有良好的抗菌活性[14]。但AAC(2')-Ia和APH(2'')-Id仍可以plazomicin为底物,分别对其环I的2'氨基进行乙酰化和磷酸化修饰,米氏常数(Km)分别为280 μmol/L和42 μmol/L。因此,Plazomicin对产AAC(2')-Ia的斯氏普罗威登斯菌、产APH(2'')-Id的肠球菌无抗菌活性[11,13,16]。


2.1 体外抗菌MIC
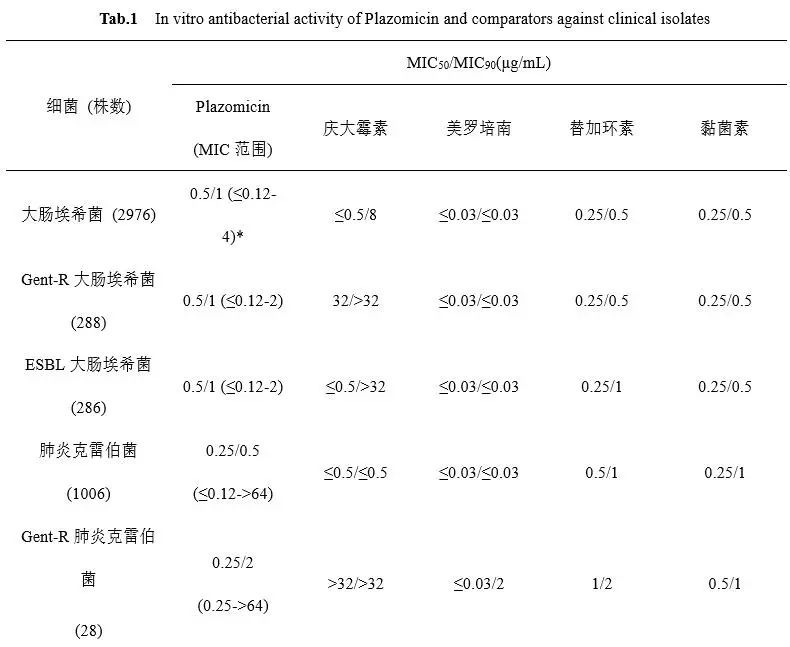
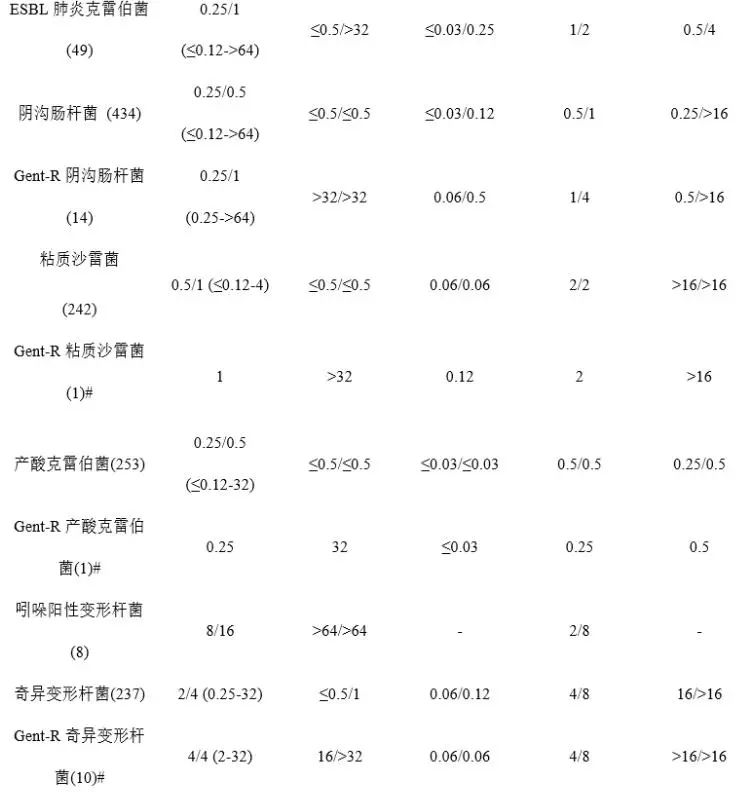
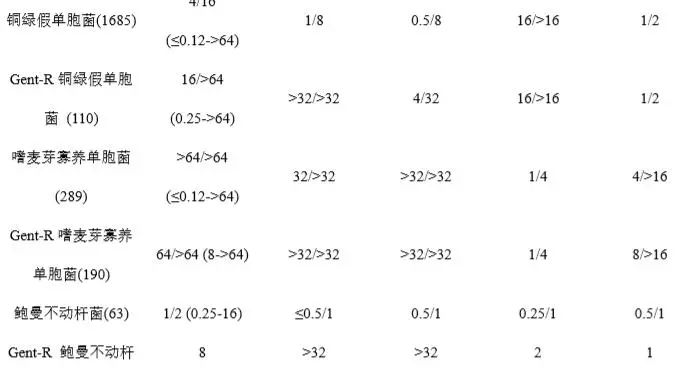
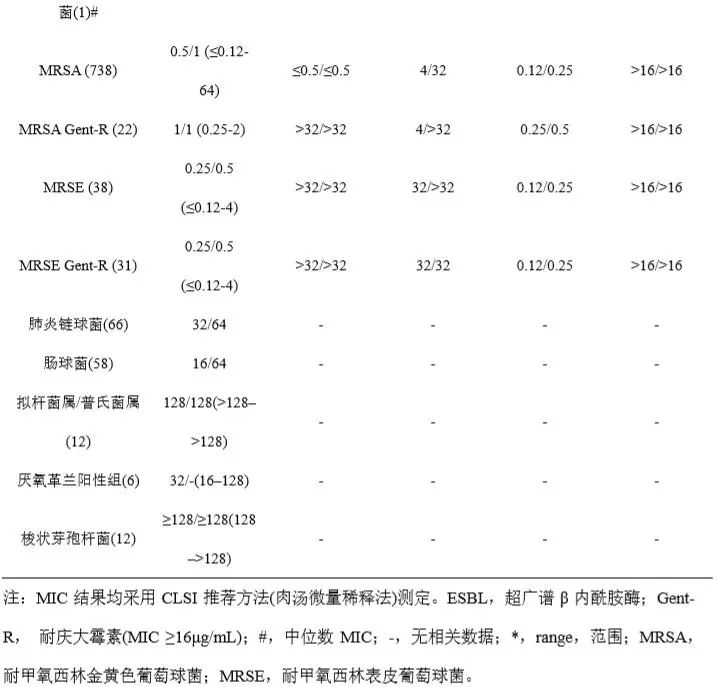
Plazomicin为广谱抗菌药,表1汇总了已报道的2011年1月至2015年12月间加拿大15家综合医院收集的16478株临床分离菌株及其他研究中收集的分离菌株对Plazomicin及对照药的体外药敏结果(MIC50/MIC90) [3,8,17,18]。数据显示,Plazomicin对大多数受试的革兰阳性、阴性需氧菌均具有良好抗菌活性,但对梭状芽孢杆菌等厌氧菌抗菌活性弱。其中,Plazomicin对包括庆大霉素耐药株、产超广谱β内酰胺酶(ESBL)耐药株在内的多数肠杆菌科细菌抗菌活性好,MIC90为0.5-4 μg/mL,与替加环素、黏菌素大体相当,而对阴沟肠杆菌、粘质沙雷菌、奇异变形杆菌的抗菌活性优于或明显优于两个对照药(替加环素MIC90:1-8 μg/mL,黏菌素MIC90:>16 μg/mL)。但其对肠杆菌科细菌的总体抗菌活性不及美罗培南(MIC90:≤0.03-2 μg/mL)。
Plazomicin对铜绿假单胞菌、吲哚阳性变形杆菌、嗜麦芽寡养单胞菌抗菌活性一般(MIC50/MIC90范围:4->64 μg/mL /16->64 μg/mL),稍优于庆大霉素[17];但对鲍曼不动杆菌的抗菌活性较好,MIC90=2μg/mL,稍弱于对照药。受试的革兰阳性菌中,其对含庆大霉素耐药株在内的葡萄球菌抗菌活性好,MIC90为0.5 -1μg/mL,明显优于美罗培南;但对肺炎链球菌和肠球菌的抗菌活性弱,MIC90为64μg/mL。
表1 Plazomicin及对照药的体外抗菌活性
2.2 体外杀菌作用
Plazomicin对敏感菌呈浓度依赖性杀菌活性。杀菌曲线结果显示,Plazomicin浓度≥4×MIC可在1-24h内杀减活细菌密度1000倍(3Log10CFU/mL)以上[19]。观察Plazomicin和几种氨基糖苷类抗生素(阿米卡星、庆大霉素,卡那霉素,壮观霉素)对布鲁氏菌(牛布鲁氏菌、羊布鲁氏菌、猪布鲁氏菌)的体外杀菌活性,结果显示庆大霉素和Plazomicin对羊布鲁氏菌、牛布鲁氏菌呈明显杀菌效果,Plazomicin对这两种病原菌的MBC/MIC比值范围分别为1-16和1-4,且Plazamicin是受试物中唯一对猪布鲁氏菌显示持续性杀菌活性的药物,MBC/MIC比值范围为1-4[20]。
2.3抗生素后效应
抗生素后效应(PAE)是指细菌与抗生素短暂接触,当药物浓度下降至低于最低抑菌浓度或消除后,细菌的生长仍受持续抑制的效应。PAE是一项重要的药效动力学参数,AGs是蛋白质合成抑制剂,PAE与细菌从被抑制到恢复蛋白质合成所需时间长短直接相关。一项针对7株肠杆菌科细菌的研究中,不同浓度的Plazomicin(2×,4×MIC)对大部分受试菌产生的PAE≥0.5h,与其他氨基糖苷药物的PAE(0.2-1.8h)相近[21]。另一项涉及9株耐多药肠杆菌的研究中,研究者比较了Plazomicin(2×,4×,8×MIC)与其他AGs(阿米卡星,庆大霉素或妥布霉素)和β-内酰胺酶类(亚胺培南或头孢他啶)药物的PAE。结果表明,Plazomicin产生的PAE与药物浓度呈正相关,在8×MIC时PAE显著大于2 h,与其他氨基糖苷类抗生素的PAE相近,而受试的β-内酰胺酶类药物的PAE<1 h[22]。


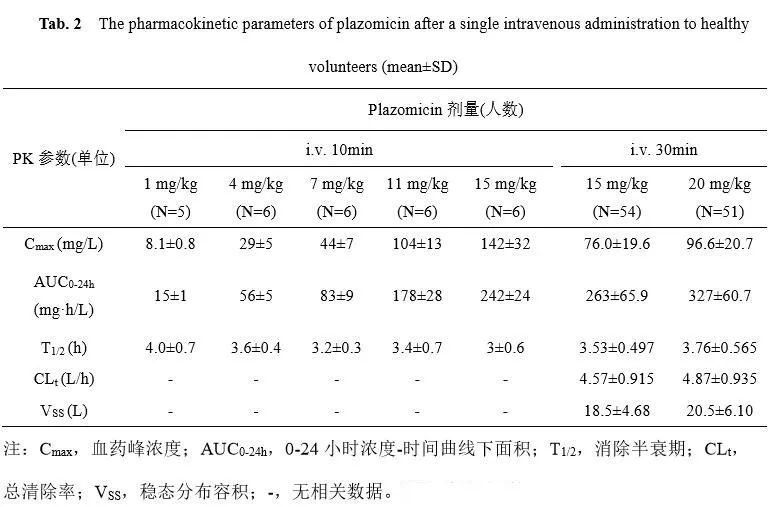
单剂量静脉给予健康受试者1 -20 mg/kg Plazomicin均表现出良好耐受性[23],该药在几组健康受试者中的药代动力学参数详见表2[14,24]。总体而言,Plazomicin的分布、体内消除等过程基本符合线性药代动力学特征,而基于群体药代动力学建模时,三室模型较为适合。Plazomicin的消除半衰期(T1/2)在4 h左右,而西索米星、庆大霉素等其他氨基糖苷类药物的T1/2为2h[14]。Plazomicin的肺渗透能力与阿米卡星相近,为12.8%[8]。
表2 健康受试者单剂静脉注射不同剂量Plazomicin的平均PK参数(mean±SD)
3.2特殊人群
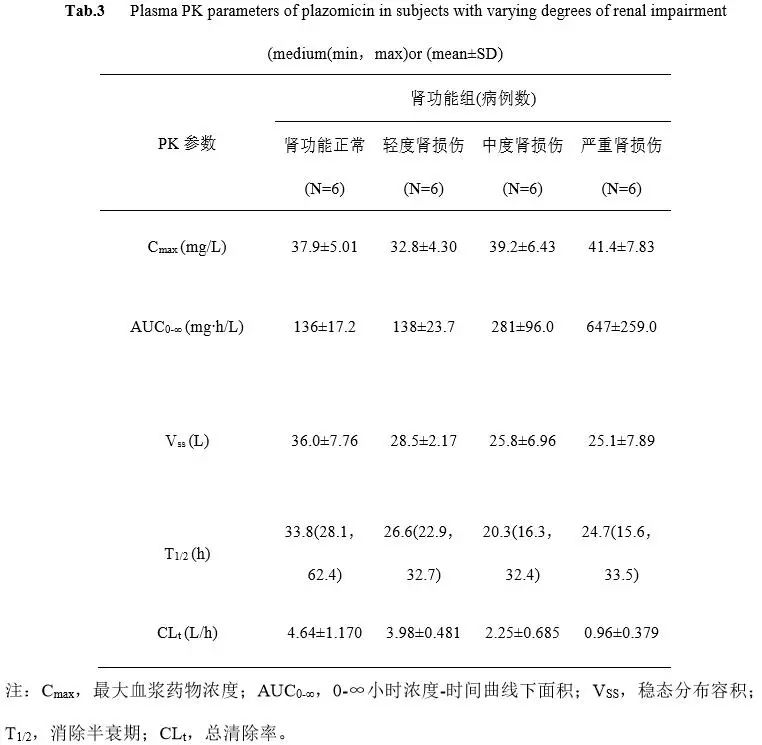
给予不同程度肾功能损伤患者7.5 mg/kg Plazomicin(i.v.)的PK参数见表3[26,27]。对于轻度肾功能不全患者,该药PK参数与健康受试者相近。给药后24h,各组Cmax值相近,范围为(37.9±5.01)mg/L (肾功能正常组)~(41.4±7.83)mg/L (严重肾损伤组)。肾功能正常组与轻度肾损伤患者给药后24h血药浓度均低于1 mg /L,AUC0-∞值相近且较低;对于中度及严重肾功能不全患者,给药后24h血药浓度约为10 mg /L,总清除率较正常组显著降低,AUC0-∞显著提高[14]。这表明,对于严重肾损伤包括接受肾脏替代疗法的患者,不建议使用Plazomicin,必须使用时应调整用药剂量以达到目标AUC。
表3 不同程度肾功能损伤受试者血浆Plazomicin PK参数(medium(min,max)或(mean±SD)
3.3 PK/PD
研究表明 ,对于Plazomicin这类浓度依赖性药物,其主要的PK-PD考察指标为AUC0-24:MIC。对于碳青霉烯耐药克雷伯菌引起的肺炎,而自身存在不同程度肾功损伤的受试患者,给予Plazomicin后,如患者血浆药物AUC:MIC≥95,则血浆细菌清除率≥98.1%[28] 。
3.4 药物相互作用
Plazomicin在体内主要经肾脏清除,因细胞色素P450酶(CYP450)抑制造成的药物相互作用风险较小。体外研究显示,25 μmol/L Plazomicin对人体内药物代谢相关的5种主要CYP450酶亚型(1A2, 2C9, 2C19, 2D6,3A4)均无明显抑制作用。因此,Plazomicin和CYP450的底物、抑制剂或诱导剂相互作用可能性较小,这可能与Plazomicin相对分子质量低,极性高,不易被代谢或不与细胞色素相互作用有关[35]。体内研究显示,药物对肝脏和肾脏药物转运体没有抑制作用,但高浓度Plazomicin可选择性抑制MATE1和MATE2-K药物转运体[8]。


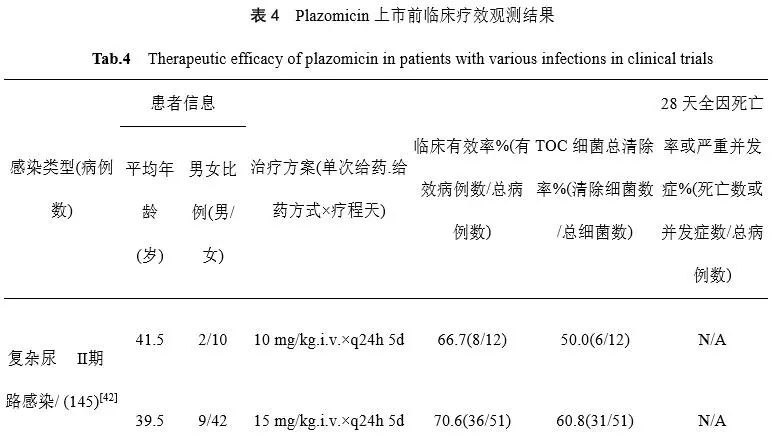
截至目前,Plazomicin已完成了复杂性尿路感染及血流感染的多中心、随机、双盲、阳性药对照研究,其中阳性药对照研究采用非劣效性评价方法。Ⅱ期双盲、阳性药对照试验中,结果表明采用Plazomicin单次/天静脉给药,连续5天给予10 mg/kg及15 mg/kg,对包括肾盂肾炎在内的复杂性尿路感染患者具有较好的微生物清除率和临床疗效,且治疗后1个月,15 mg/kg治疗组微生物复发率(6.5%)明显低于左氧氟沙星治疗组(23.5%)[29]。Ⅲ期临床试验(EPIC,NCT02486627)中,观察Plazomicin对复杂性尿路感染的疗效,结果显示15 mg/kg Plazomicin(i.v.)治疗结束后2-3周,综合治愈率明显高于美罗培南治疗组,且微生物和临床复发率较低[30,31]。
治疗碳青霉烯类耐药肠杆菌科细菌(CRE)血流感染的Ⅲ期临床试验(NCT01970371)表明,与黏菌素治疗组相比,Plazomicin治疗组患者病死率更低,重复感染或新感染发生率降低。未出现患者对Plazomicin敏感性下降或耐药发生的情况[32,33]。但该项研究由于样本量小,未进行正式的假设检验等因素,FDA咨询委员会认为该试验尚无法提供关于Plazomicin治疗血流感染安全性和有效性的实据。因此,目前FDA尚未批准Plazomicin用于治疗血流感染[34]。Plazomicin上市前临床疗效观测结果详见表4。
表4 Plazomicin上市前临床疗效观测结果


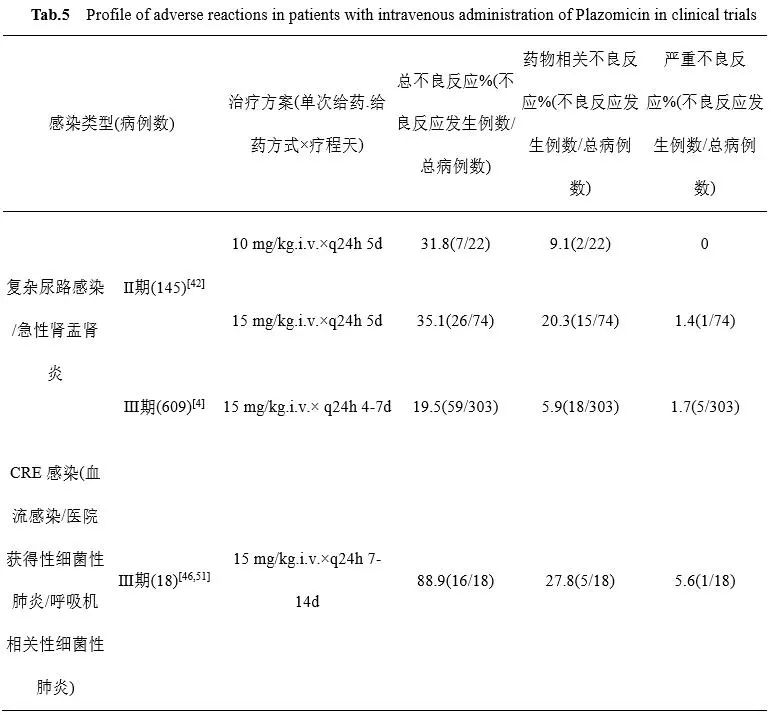
作为新一代氨基糖苷类药物,Plazomicin总体安全性较好,在正常疗程内,与阿米卡星、庆大霉素等同类药相比,其的肾毒性明显低于后者(约5% vs 10 - 25%)[37]。Ⅰ期、Ⅱ期临床研究表明,静脉给予Plazomicin 1-20 mg/kg,受试者均耐受良好。Ⅱ期治疗cUTI和急性肾盂肾炎临床研究中,10 mg/kg及15 mg/kg Plazomicin治疗组患者不良反应发生率分别为31.8%,35.1%,均低于750 mg/日左氧氟沙星对照组(47.7%),未见感音神经性、传导性或混合性听力受损等不良反应[42]。Ⅲ期治疗复杂性尿路感染和急性肾盂肾炎临床研究中,虽然Plazomicin组患者总不良事件发生率为19.5%,但仅5.9%与药物治疗相关。Plazomicin对肾功能的影响与美罗培南相近,静脉给药治疗期间患者血清肌酐增加≥5 mg/L的发生率为3.7%(n=11/300)[8]。受试患者常见不良反应以轻、中度消化道和中枢神经反应为主,包括耳鸣,耳部不适,头痛,嗜睡,恶心,感觉减退,头晕和视力模糊,停药后可恢复[8,14]。治疗CRE感染的Ⅲ期临床试验期间,接受Plazomicin治疗的多数重症患者至少出现过一种不良反应,发生率为88.9%,药物相关不良反应发生率为27.8%,严重不良反应发生率为5.6%,血清肌酐增加≥ 5 mg/L的发生率为8.3%,均低于黏菌素治疗组。其中,肾功能相关不良反应和败血症发生率明显低于黏菌素治疗组(31.3% vs. 52.4%, 20.8% vs. 38.1%),但心脏骤停、低血压、贫血、腹泻等不良反应发生率高于黏菌素治疗组(12.5% vs. 9.5% , 10.4% vs. 0%, 10.4% vs. 9.5%, 10.4% vs. 9.5%)[8,38]。
总体而言,肾功不全患者、老年患者、同时接受肾毒性药物治疗的患者,使用Plazomicin时肾毒性反应风险较大。氨基糖苷类药物相关耳毒性可见于有听力丧失家族史的患者、肾损害患者、用药量高于推荐剂量或用药时间过长患者。另外,治疗期间应监测与神经肌肉阻滞相关的不良反应[39]。目前尚无孕妇或哺乳期妇女使用Plazomicin的相关数据,但建议妊娠期间不要使用Plazomicin,避免对胎儿造成损伤[8]。药物上市前不良反应监测结果详见表5。
表5 Plazomicin上市前患者不良反应监测结果


Plazomicin作为氨基糖苷类药物,属于静止期杀菌药,抗生素后效应较长,杀菌完全,可与其他抗菌机制药物如繁殖期杀菌药β-内酰胺类抗生素或糖肽类抗生素联用,提高疗效,治疗诸如需氧革兰阳性、阴性菌引起的复合感染,尤其对于不能耐受β-内酰胺类和磺胺类药物的患者,它的面市无疑为这类患者增加了新的选择。与前几代氨基糖苷类药物品种比较,Plazomicin具有毒性较低、对多数AMEs稳定、抗菌谱更广的优势,因此,Plazomicin在其他国家也有不错的上市前景。总之,开发耐酶、低毒的新一代氨基糖苷药物是目前及将来研究的重点,如何通过结构修饰克服16S rRNA甲基转移酶产生的耐药也将是未来研究的方向。而上市后规范化的用药,则是进一步延长药物使用寿命的前提。
参考文献
[1]Kun S, Caldwell S J, Fong D H, et al. Prospects for circumventing aminoglycoside kinase mediated antibiotic resistance[J]. Front Cell Infect Mi, 2013, 3.
[2]刘汉阳, 赵伟伟, 朱雪焱, 等. 新型氨基糖苷类抗菌药plazomicin的合成[J]. 中国医药工业杂志, 2017, 48(05): 656-661.
[3]Aggen J B, Armstrong E S, Goldblum A A, et al. Synthesis and Spectrum of the Neoglycoside ACHN-490[J]. Antimicrob Agents Ch, 2010, 54(11):4636-4642.
[4]Achaogen, Inc. FDA Briefing Document: Plazomicin sulfate Injection Meeting of the Antimicrobial Drugs Advisory Committee (AMDAC)[EB/OL].(2018-05-02)[2018-11-20] https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/Anti-InfectiveDrugsAdvisoryCommittee/UCM606039.pdf.
[5] 张婷婷, 魏增泉. 临床研究中的抗生素新药[J]. 国外医药抗生素分册, 2013, 34(6):243-249.
[6]Sonousi A, Sarpe VA, Brilkova M, et al. Effects of the 1-N-(4-Amino-2S-hydroxybutyryl) and 6’-N-(2-Hydroxyethyl) Substituents on Ribosomal Selectivity, Cochleotoxicity and Antibacterial Activity in the Sisomicin Class of Aminoglycoside Antibiotics[J]. ACS Infect Dis, 2018, 7(4):1114-1120.
[7]简心韵, 邓子新, 孙宇辉. 氨基糖苷抗生素庆大霉素:基础研究的新进展及应用研究的新潜力[J]. 生物工程学报, 2015, 31(6):829-844.
[8]Shaeer KM, Zmarlicka MT, Chahine EB, et al. Plazomicin, a Next-Generation Aminoglycoside[J/OL]. Pharmacotherapy, (2018-12-04) [2019-1-03] https://doi.org/10.1002/phar.2203.
[9] Walter F, Vicens Q, Westhof E. Aminoglycoside–RNA interactions[J]. Curr Opin Chem Biol, 1999, 3(6):694-704.
[10]Woodcock J, Moazed D, Cannon M, et al. Interaction of antibiotics with A- and P-site-specific bases in 16S ribosomal RNA[J]. Embo J, 1991, 10(10):3099-3103.
[11]Cox G, Ejim L, Sieron A, et al. A Comprehensive Study of Plazomicin Activity against a Panel of Aminoglycoside Resistance Enzymes [EB/OL]. (2016-06-20) [2018-11-01] http://www.achaogen.com/media-all/2016/6/20/a-comprehensive-study-of-plazomicin-activity-against-a-panel-of-aminoglycoside-resistance-enzymes.
[12]潘韵峰,周华,俞云松.导致高水平氨基糖苷类药物耐药的新型16S rRNA甲基化酶研究进展[J]. 中华检验医学杂志, 2007, 30(6):699-701.
[13]Zhanel GG, Lawson CD, Zelenitsky S, et al. Comparison of the Next-Generation Aminoglycoside Plazomicin to Gentamicin, Tobramycin and Amikacin[J]. Expert Rev Anti-infe, 2012, 10(4):459–473.
[14]Karaiskos I, Souli M, Giamarellou H. Plazomicin: An investigational therapy for the treatment of urinary tract infections[J]. Expert Opin Inv Drug, 2015, 24(11):1-11.
[15]Almaghrabi R, Clancy CJ, Doi Y, et al. Carbapenem-Resistant Klebsiella pneumoniae Strains Exhibit Diversity in Aminoglycoside-Modifying Enzymes, Which Exert Differing Effects on Plazomicin and Other Agents[J]. Antimicrob Agents Ch, 2014, 58(8):4443-4451.
[16]Armstrong ES, Miller GH. Combating evolution with intelligent design: the neoglycoside ACHN-490[J]. Curr Opin Microbiol, 2010, 13(5):565-573.
[17]Zhanel GG, Adam HJ, Baxter M, et al. In vitro activity of plazomicin against gram-negative and gram-positive pathogens isolated from patients in Canadian hospitals in 2011-2015: CANWARD surveillance study [EB/OL]. (201-06-04) [2018-11-21] http://www.achaogen.com/media-all/2017/6/4/in-vitro-activity-of-plazomicin-against-gram-negative-and-gram-positive-pathogens-isolated-from-patients-in-canadian-hospitals-in-2011-2015-canward-surveillance-study.
[18]Castanheira M, Davis AP, Mendes RE, et al. In Vitro Activity of Plazomicin against Gram-Negative and Gram-Positive Isolates Collected from U.S. Hospitals and Comparative Activities of Aminoglycosides against Carbapenem-Resistant Enterobacteriaceae and Isolates Carrying Carbapenemase Genes[J]. Antimicrob Agents Ch, 2018, 62(8): e00313-18.
[19]Thwaites M, Hall D, Shinabarger D. An Evaluation of the Bactericidal Activity of Plazomicin and Comparators against Multidrug Resistant Enterobacteriaceae [EB/OL]. (2016-06-20) [2018-11-10] http://www.achaogen.com/media-all/2016/6/20/an-evaluation-of-the-bactericidal-activity-of-plazomicin-and-comparators-against-multidrug-resistant-enterobacteriaceae.
[20]Olsen SC, Carlson SA. In vitro bactericidal activity of aminoglycosides, including the next-generation drug plazomicin, against Brucella spp.[J]. Int J Antimicrob Ag, 2015, 45(1):76-78.
[21]Serio AW, Kubo A, Armstrong ES, et al. Plazomicin, a Novel Aminoglycoside, Exhibits a Post-Antibiotic Effect Against Enterobacteriaceae [EB/OL]. (2015-09-22) [2018-11-23] http://www.achaogen.com/media-all/2015/9/24/plazomicin-a-novel-aminoglycoside-exhibits-a-post-antibiotic-effect-against-enterobacteriaceae.
[22]Hall D, Thwaites M, Shinabarger D, et al. Investigating the Post-Antibiotic Effect of Plazomicin against Multidrug Resistant Enterobacteriaceae [EB/OL]. (2017-06-04) [2018-11-11] http://www.achaogen.com/media-all/2017/6/4/investigating-the-post-antibiotic-effect-of-plazomicin-against-multidrug-resistantenterobacteriaceae.
[23]Riddle V, Mason J, Cebrik D, et al. The Effect of Plazomicin Injection on the QT/QTc Interval in Healthy Volunteers [EB/OL]. (2013-09-16) [2018-11-11] http://www.achaogen.com/media-all/2013/9/16/the-effect-of-plazomicin-injection-on-the-qtqtc-interval-in-healthy-volunteers.
[24]Seroogy J, Choi T, Gall J, et al. Pharmacokinetics (PK) of Plazomicin in Healthy Adults [EB/OL]. (2017-06-04) [2018-11-01] http://www.achaogen.com/media-all/2017/6/4/pharmacokinetics-pk-of-plazomicin-in-healthy-adults.
[25]Cass RT, McKinnell JV, Xie B, et al. Pharmacokinetics of the Novel Neoglycoside ACHN-490 in Mouse, Rat, and Dog [EB/OL]. (2009-09-13) [2018-11-01] http://www.achaogen.com/media-all/2009/9/13/pharmacokinetics-of-the-novel-neoglycoside-achn-490-in-mouse-rat-and-dog.
[26]Riddle V, Cebrik D, Kostrub C, et al. The pharmacokinetics (PK) and safety of plazomicin in subjects with renal impairment [EB/OL]. (2013-05-01) [2018-11-10] http://www.achaogen.com/media-all/2013/7/31/the-pharmacokinetics-pk-and-safety-of-plazomicin-in-subjects-with-renal-impairment.
[27]Komirenko AS, Riddle V, Gibbons JA, et al. A Phase 1 Study to Assess the Pharmacokinetics of Intravenous Plazomicin in Adult Subjects with Varying Degrees of Renal Function[J/OL]. Antimicrob Agents Ch, 2018, 62(12): e01128-18. [2018-11-10]. https://aac.asm.org/content/62/12/e01128-18.
[28]VanWart SA, Forrest A, Bulik CC, et al. Pharmacokinetic-pharmacodynamic assessment predicts a high probability of efficacy for plazomicin against serious infections caused by carbapenem-resistant Enterobacteriaceae [EB/OL]. (2013-09-16) [2018-11-10] http://www.achaogen.com/media-all/2013/9/16/pharmacokineticpharmacodynamic-pkpd-assessment-predicts-high-efficacy-for-plazomicin-against-serious-infections-caused-by-carbapenem-resistant-klebsiella-pneumoniae-cr-kp.
[29]Connolly LE, Riddle V, Cebrik D, et al. Efficacy and Safety of Plazomicin Compared with Levofloxacin in the Treatment of Complicated Urinary Tract Infection and Acute Pyelonephritis: A Multicenter, Randomized, Double-Blind, Phase 2 Study[J]. Antimicrob Agents Ch, 2018:AAC.01989-17.
[30]Cloutier D, Komirenko A, Cebrik D, et al. Plazomicin Versus Meropenem for Complicated Urinary Tract Infection (cUTI) and Acute Pyelonephritis (AP): Diagnosis-specific Results from the Phase 3 EPIC Study [EB/OL]. (2017-10-07) [2018-12-01] http://www.achaogen.com/media-all/2017/10/6/plazomicin-versus-meropenem-for-complicated-urinary-tract-infection-cuti-and-acute-pyelonephritis-ap-diagnosis-specific-results-from-the-phase-3-epic-study.
[31]Golan Y, Cloutier D, Komirenko A, et al. Improved Outcomes at Late Follow-up (LFU) with Plazomicin Compared with Meropenem in Patients with Complicated Urinary Tract Infection (cUTI) or Acute Pyelonephritis (AP) in the EPIC Study [EB/OL]. (2017-10-07) [2018-11-01] http://www.achaogen.com/media-all/2017/10/6/improved-outcomes-at-late-follow-up-lfu-with-plazomicin-compared-with-meropenem-in-patients-with-complicated-urinary-tract-infection-cuti-or-acute-pyelonephritis-ap-in-the-epic-study.2017-10-07,Poster abstract #1859, Session: Clinical Study with New Antibiotics and Antifungals.
[32]Pontikis K, Skiada A, Serio AW, et al. Plazomicin is Associated with Fewer Post-Baseline Infectious Complications Compared with Colistin in Patients with Serious Infections due to Carbapenem-Resistant Enterobacteriaceae [EB/OL]. (2018-04-22) [2018-11-10] http://www.achaogen.com/media-all/2018/4/22/plazomicin-is-associated-with-fewer-post-baseline-infectious-complications-compared-with-colistin-in-patients-with-serious-infections-due-to-carbapenem-resistant-enterobacteriaceae.
[33]Daikos G, Connolly L, Jubb A, et al. Plazomicin (PLZ) Associated with Improved Survival and Safety Compared to Colistin (CST) in Serious Carbapenem-Resistant Enterobacteriaceae (CRE) Infections: Results of the CARE Study [EB/OL]. (2017-06-05) [2018-11-01] http://www.achaogen.com/media-all/2017/6/3/plazomicin-plz-associated-with-improved-survival-and-safety-compared-to-colistin-cst-in-serious-carbapenem-resistantenterobacteriaceaecre-infections-results-of-the-care-study.
[34]Theuretzbacher U, Paul M. Developing a new antibiotic for extensively drug-resistant pathogens: the case of plazomicin[J]. Clin Microbiol Infec, 2018,24(12):1231-1233.

