2021-08-19 20:35
作者 李子尧、鲁炳怀

京港感染论坛
早诊快诊,助力精准防治
2021年3月15日,华南农业大学刘健华教授团队在Nucleic Acids Research杂志上发表“AProQ/FinO family protein involved in plasmid copy number control favours fitness of bacteria carrying mcr-1-bearing IncI2 plasmids”的学术论文。

质粒介导的粘菌素耐药基因mcr-1的出现和传播给公共卫生带来了巨大挑战。IncI2型质粒被是在全球传播mcr-1最成功的载体。除了mcr-1,IncI2质粒还携带其他临床相关的耐药基因。然而,IncI2质粒如何适应宿主菌并维持耐药基因(尤其是mcr-1)稳定存在的机制仍知之甚少。因此本文作者对基于质粒编码的调控因子控制携带mcr-1的IncI2质粒的适应性代价的相关调控机制进行了研究。本研究揭示了一种新的与质粒相关的适应机制,这种机制有助于携带mcr-1的IncI2质粒在自然界中长期稳定存在。
研究首先运用比较基因组学比较分析了pHNSHP45(携带mcr-1基因的IncI2质粒)的质粒骨架和分子结构。本研究使用Pfam数据库对共有的核心基因进行分析,发现了三个假定的转录调节因子(ORF00039、ORF00049和ORF00050)。未验证所预测的转录条件因子的功能,本研究构建了相关蛋白缺失突变菌株,并监测生长曲线和竞争实验来确定其适应性代价(fitness cost)。结果发现仅ORF00049(pcnR,编码ProQ/FinO家族蛋白)的缺失延迟并减少细菌的生长,产生较小菌落和高适应性代价(图1A、B、C)。△PcnR突变的回补菌株恢复了宿主细菌的生长和适应性。证实pcnR对pHNSHP45的适应性是必需的。
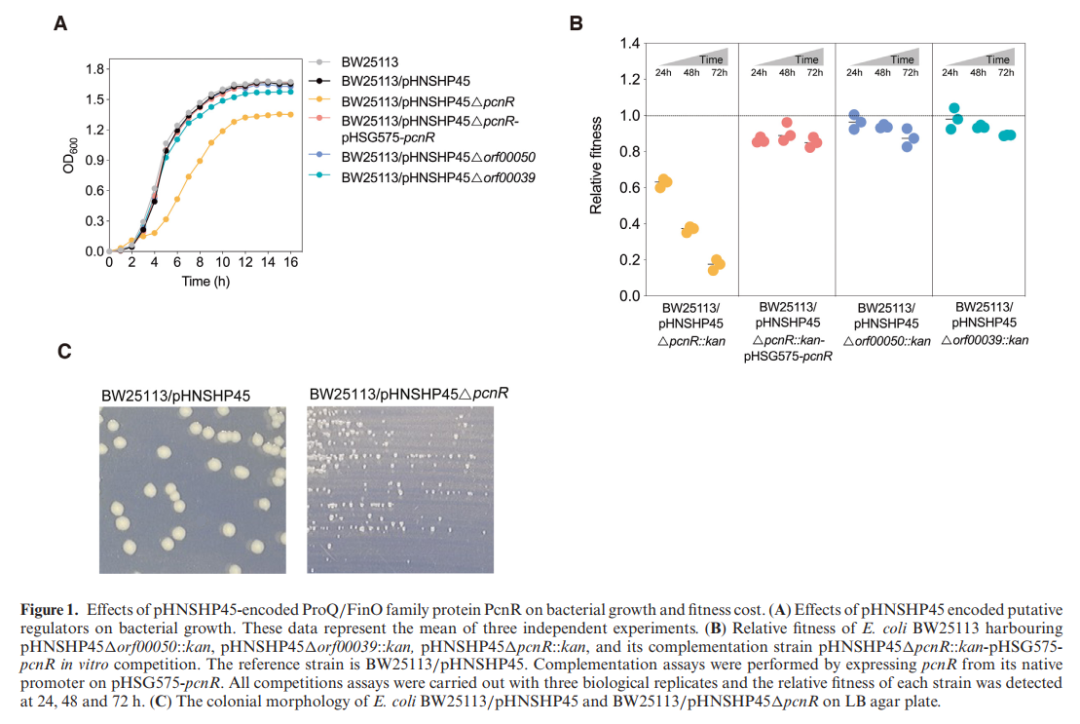
图1:pHNSHP45编码的ProQ/FinO家族蛋白PcnR对细菌生长和适应性代价的影响
PcnR的结构域与FinO蛋白相似,且PcnR的缺失可导致质粒转移频率增加,与FinO调节质粒接合转移的功能相似。pHSG575来源的PcnR蛋白回补至突变菌株后,可使质粒转移频率恢复至野生菌株水平。但PcnR对质粒转移频率的影响程度远低于FinO,以FinO回补△pcnR,没有恢复质粒转移频率或生长率,表明PcnR和FinO可能调控不同的靶基因。PcnR可能是与FinO相似的RNA结合蛋白。
用卡那霉素耐药的转座子随机插入到HNSHP45△pcnR的大肠埃希菌BW25113 (实验菌株是E.coli BW25113,而该菌株携带质粒pHNSHP45,而这个质粒的pcnR基因缺失)中,构建转座子突变文库。选择生长率接近野生型菌株的7个大菌落(Tns1至Tns7),进行TAIL-PCR鉴定转座子插入位点,所有插入位点均位于染色体,包括arnT位点(Tns6)。测序后发现在Tns1、Tns2、Tns3和Tns7变体中,nikB和pilP之间缺失了一个包含mcr-1的15-19kb区域(图2A)。表明mcr-1的缺失可以补偿由△pcnR突变引起的适应性代价。Tns4在mcr-1启动子存在一个点突变(图2A和B)。之后用RT-qPCR发现Tns4中mcr-1的转录水平明显低于BW25113/pHNSHP45△pcnR(图2B)。综上所述,转座子突变体生长率的恢复可能与mcr-1的丢失或表达减少有关。
研究进一步构建了△pcnR△mcr-1突变体,发现mcr-1的缺失恢复了△pcnR菌株的生长,也增加了相对适应度,如图2C和D。此外,回补菌株表达mcr-1导致生长迟缓和高适应性代价(图2C和D)。综上,mcr-1的高表达导致△pcnR菌株高适应性代价。
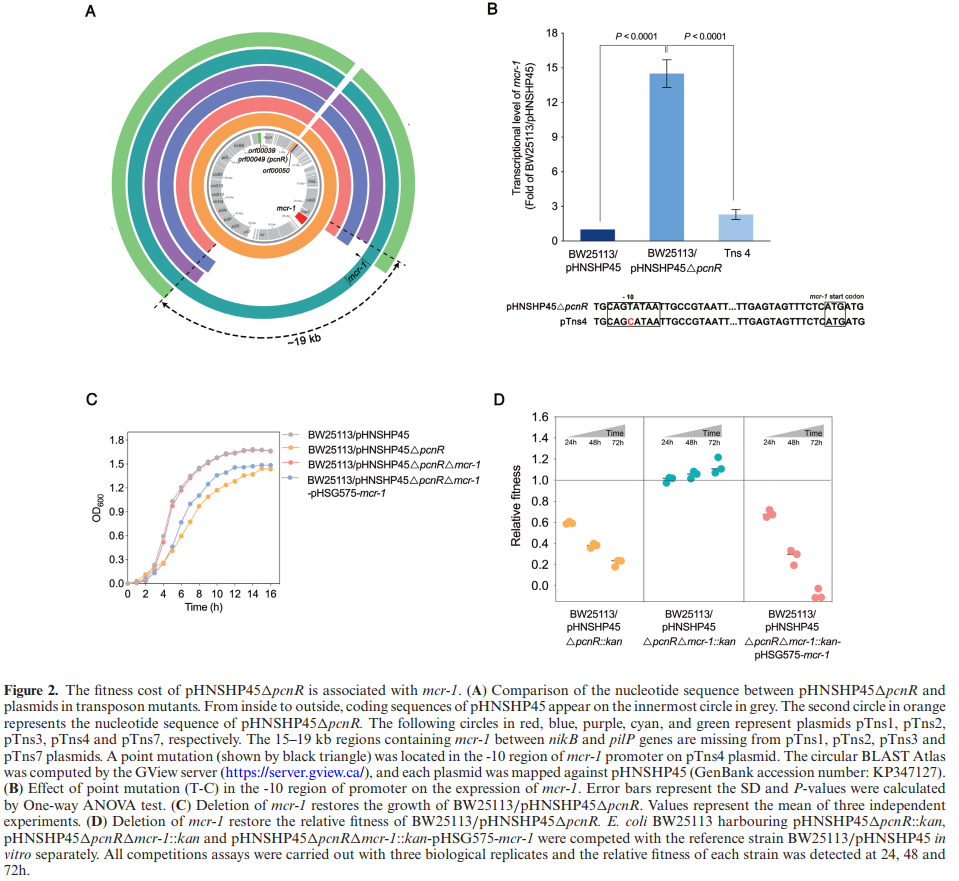
图2:pHNSHP45△pcnR与mcr-1相关的适应性代价
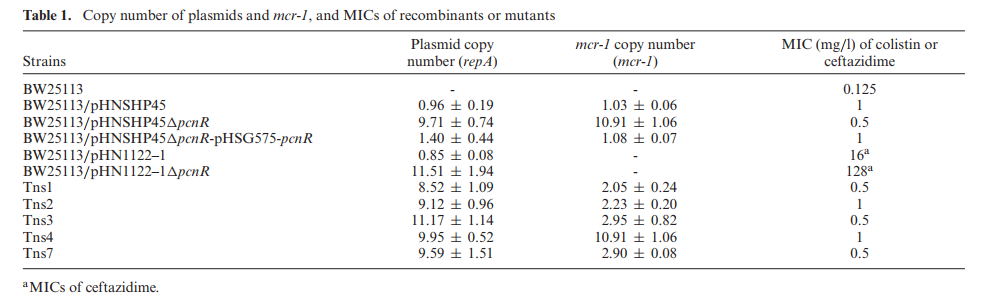
研究测定转座子插入突变体的粘菌素的MIC,发现Tns1、Tns2、Tns3和Tns7对粘菌素仍耐药(表1)。因此怀疑这些突变体可能携带一个mcr-1缺失质粒和完整的pHNSHP45质粒,导致这些突变体的粘菌素耐药。本研究通过PCR在突变菌株中检测到完整的mcr-1基因盒,表明pHNSHP45可能在这些突变体中多拷贝存在。但IncI2是低拷贝质粒,故本研究推测pcnR的缺失会增加质粒拷贝数,质粒中mcr-1的缺失引起转座子突变体的生长恢复。本研究测定了所有菌株的质粒拷贝数(表1)。pHNSHP45△pcnR的拷贝数明显高于野生质粒的拷贝数,且pcnR蛋白回补菌株可以恢复pHNSHP45△pcnR质粒为单拷贝质粒(表1)。表明pcnR可抑制质粒复制,降低其拷贝数。比较各转座子插入突变菌株的质粒拷贝数和mcr-1基因的相对拷贝数(表1),发现mcr-1基因拷贝数的增加与质粒拷贝数的增加成正相关,而mcr-1拷贝数的增加会带来相应的生存适应性代价。因此,转座子突变体可能由于质粒中含有mcr-1的缺失导致低mcr-1拷贝。另外,mcr-1在BW25113/pHNSHP45△pcnR中的转录水平的表达比BW25113/pHNSHP45高(图2B)。表明质粒拷贝数增加导致mcr-1基因mRNA高表达,因此使BW25113/pHNSHP45△pcnR的生长率降低。
表1:质粒和mcr-1的拷贝数,突变体的MIC值
通过测定BW25113/pHNSHP45和BW25113/pHNSHP45△pcnR的粘菌素MIC及BW25113/pHN1122–1(一种IncI2质粒,有blaCTX-M-55和与pcnR相同的基因)及BW25113/pHN1122–1△pcnR的头孢他啶MIC。研究发现头孢他啶的MIC随着质粒拷贝数的增加而增加,而粘菌素的MIC与质粒拷贝数无关。本研究通过进行竞争实验(突变菌株和野生菌株共培养计数做比值)来比较mcr-1和blaCTX-M-55基因给BW25113细菌中生存适应性代价所造成的影响。经过10天观察,结果发现BW25113/pHN1122–1△blaCTX-M-55菌株的适应度未降低,而BW25113/pHNSHP45△mcr-1的适应度在10天内显著降低(图3A、B)。该结果表明天然质粒携带的单拷贝mcr-1也产生适应性代价,而且其mcr-1基因的拷贝数是野生型菌株的10倍,对宿主细菌造成更高的成本(表1)。因此,mcr-1高表达引起的适应性代价的增加可能导致BW25113/pHNSHP45△pcnR中粘菌素MIC降低。
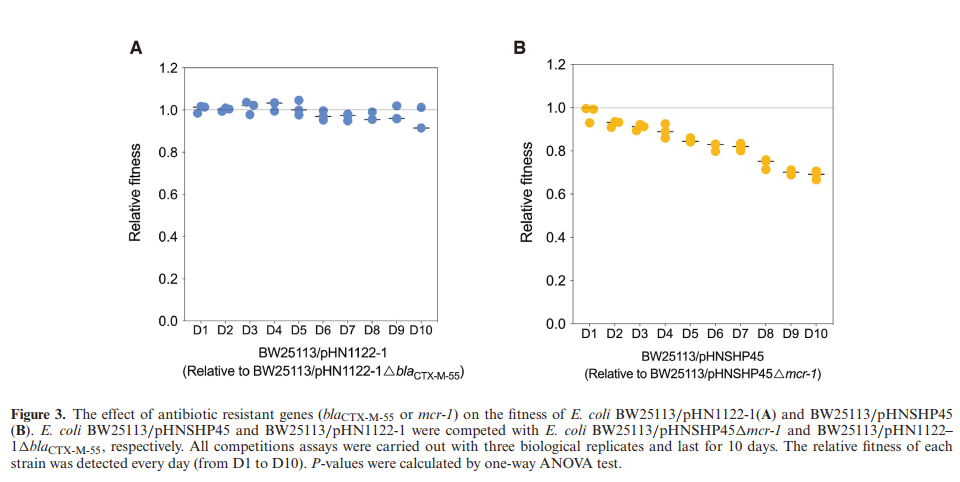
图3:耐药基因对大肠杆菌BW25113/pHN1122-1适应性的影响
repA(编码质粒分裂蛋白)蛋白是质粒复制的关键蛋白,本研究通过β-半乳糖苷酶活性实验来检测pcnR蛋白对repA的表达调控作用。本研究将repA(编码质粒分裂蛋白)的上游片段(497到+45)与无启动子的lacZ基因融合(图4A),并检测β-半乳糖苷酶活性来检测repA的表达。pcnR表达时,β-半乳糖苷酶活性显著降低(图4B),证实pcnR抑制了repA的表达。分析其结构表明,编码19个氨基酸前导肽的repR的ORF与repA的起始密码子重叠(图4A)。在RepR的+23位引入了终止密码子后(图4C),PrepA-lacZ的表达明显降低,表明repR对repA的表达是必需的。
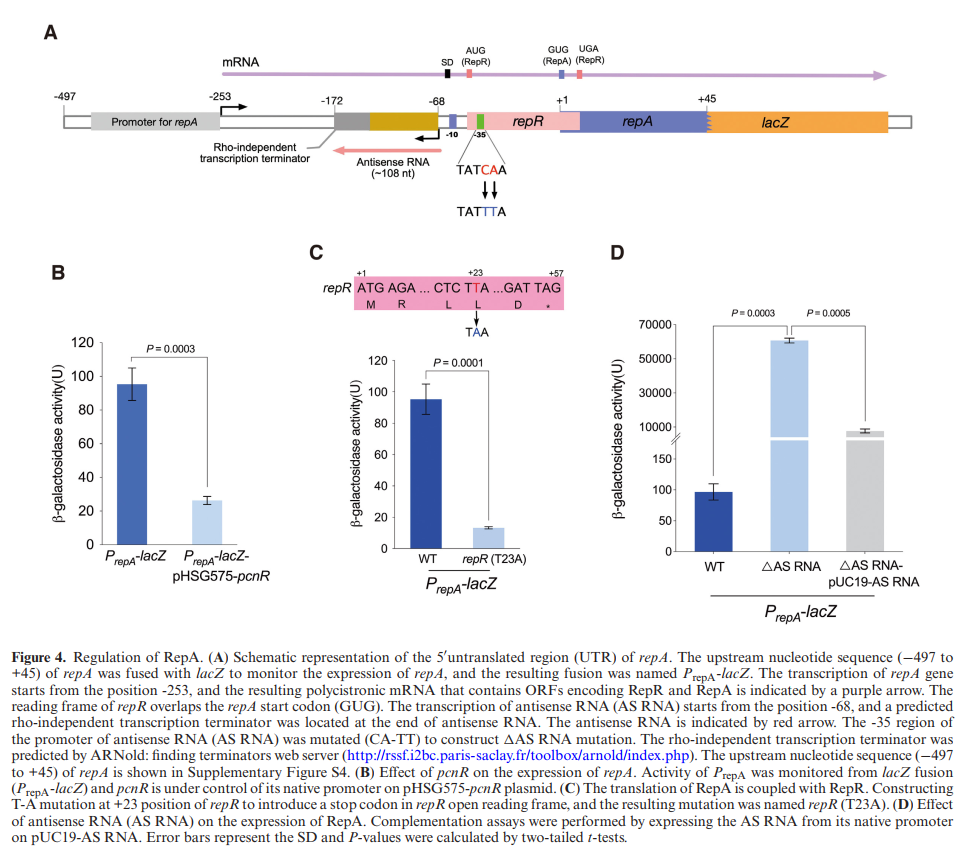
图4:RepA的调节
通过5’cDNA末端的快速扩增(RACE)检测到一个ASRNA和repA的转录起始位点的存在。如图4A所示,发现ASRNA与repAmRNA的前导区是互补的,表明ASRNA可能与repAmRNA的前导区结合来负调节repA的表达。在其启动子的–35处引入突变(CA-TT)来终止ASRNA转录(图4A),并将lacZ融合到repA阅读框。如图4D所示,PrepA-LacZ(△ASRNA)的β-半乳糖苷酶活性与野生型相比显著增加。然而,pUC19对ASRNA的表达仅部分回补△ASRNA的突变。通过分析该基因的二级结构,RepR起始密码子附近的RNA序列形成了SL结构(图5A),这可能阻止RepR的翻译。部分回补的△ASRNA突变可能是+16和+17位的突变引起mRNA茎结构损伤。随后,引入了TA突变(位置–7和–4)到△ASRNA菌株恢复repRmRNA的茎结构。该突变降低了repA的表达。在△ASRNA菌体(TA突变体)内,ASRNA将repA的表达降低到野生型水平。这些结果表明ASRNA抑制了repA的表达。
考虑PcnR可能与ASRNA结合来抑制repA表达(与FinO相似)。遂使用纯化PcnR,进行电泳迁移率偏移分析(RNA-EMSA)。结果PcnR未能与ASRNA结合。之后在BW25113/PrepA-LacZ△ASRNA引入PcnR。PcnR也降低了repA的表达(图5B),表明repA的PcnR抑制与ASRNA无关。在+9、+10、+11和+12位(茎内,破坏SL结构)及+5和+6位(环残基,不影响SL结构)引入突变(图5A),lacZ与repA阅读框融合来证明PcnR可能结合SL结构来抑制repRmRNA。同时将lacZ分别融合到+9位(repR9)(不存在SL)和+24位(repR24)(存在SL)来探究PcnR对repR表达的抑制作用。茎内突变几乎消除了PcnR对repA表达的抑制作用(图5C),同时repA表达增加。环残基突变对PcnR的抑制作用影响不大(图5C)。没有SL(RepR9)的情况下,PcnR不影响RepR的表达;有SL(RepR24)的情况下,PcnR抑制了RepR的表达(图5C)。因此,SL结构可能在PcnR对RepA的抑制作用中起主要作用。
之后用RNA-EMSA分析含有该SL结构的小RNA,证明PcnR和含有RepR起始密码子的SL结构之间的相互作用。结果如图5D所示,表明PcnR与小RNA结合。综上,PcnR通过与repR基因的SL结构结合来抑制repA的表达。

图5:PcnR通过与RepAmrna结合来调节RepA的表达
使用竞争实验及质粒入侵实验比较了pHNSHP45、pHNSHP45△pcnR::kan和pHNSHP45△pcnR△mcr-1::kan的持久性。同时还比较pHNSHP45和pHNSHP45△mcr-1::kan来探究mcr-1对IncI2质粒侵袭性的影响。
pHNSHP45的侵袭效应明显优于pHNSHP45△pcnR::kan(图6A),且pHNSHP45△pcnR::kan的数量迅速下降(图6B),说明质粒水平转移不足以抵消适应性代价。在无mcr-1的情况下,pcnR-质粒可以侵入多数细胞(图6D)。竞争性共培养中的情况(图6E)与单独共培养中的相似(图6A和B)。但pHNSHP45△pcnR△mcr-1::kan入侵速度更快,且有长期竞争优势(图6D和G)。表明pcnR对于携带mcr-1的IncI2质粒的持久性和侵袭性很重要。在竞争性共培养条件下(图6F),48小时后,pHNSHP45△MCR-1::kans比pHNSHP45有更长期的竞争优势,表明mcr-1带来高适应性代价,并降低其竞争优势。
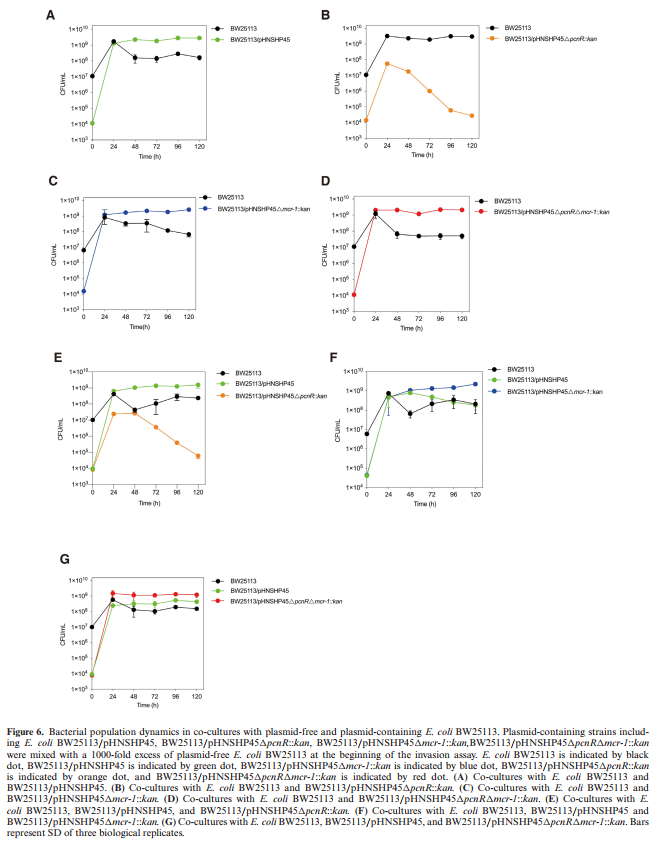
图6:质粒侵袭实验与共培养竞争实验

综上所述,IncI2质粒的PcnR蛋白,可通过抑制质粒复制,降低拷贝数来平衡mcr-1的表达和细菌适应性。其可与repRmRNA的SL结合来抑制RepA的表达。pcnR对于携带MCR-1的IncI2质粒的持久性存在至关重要。即使单拷贝的mcr-1基因也会产生适应性代价,并使其竞争力及持久性存在产生消极影响。这些结果解释了我国禁用粘菌素作为饲料添加剂后mcr-1流行率显著降低的原因。
作者简介

李子尧
中日友好临床医学研究所2020级临床检验诊断学硕士研究生,研究方向:肺炎克雷伯菌耐药机制。2020年毕业于四川大学华西临床医学院医学检验技术专业,获理学学士学位。指导教师:中日友好医院,鲁炳怀教授。

鲁炳怀
中日医院,呼吸与危重症医学科。主任医师,医学博士,北京大学医学部教授,北大医学部与协和医学院硕士生导师。社会兼职,中华医学会检验分会微生物学组委员,中国医促会临床微生物与感染分会常委。主持多项国家级与省部级科研项目。发表SCI收录专业文章近30篇。
END
作者|李子尧、鲁炳怀
审校|陈宏斌、余方友



