2021-09-03 17:27
作者 吴海玲、王夏珍等

京港感染论坛
十年京港,逐梦感染病精准诊疗
引 言
花季少年反复发生感染,“肺炎”、“肺脓肿”、“阑尾炎”交替出现,困扰着临床医生与患者家人,此类疾病的诊断鉴别要点有哪些?如何从宿主因素去思考肺炎发生的病理生理学机制?如何真正做到“宿主与病原”双精准治疗?本例患者自幼反复、多部位感染,经验性抗感染有效,伴粒细胞重度缺乏,这个经典案例有注意回答上述临床问题。
病情简介
患者,男性,15岁11月,以“反复发热、咳嗽15年余”于2021年3月10日入中日友好医院。
患者出生40天时出现发热、咳嗽,当地医院诊断为“肺炎”,住院治疗1周后好转。出院后间断发热,未监测体温,热型不明确,约每月1次,予抗感染治疗后均可好转,此种情况持续至2周岁;此后每2-3月发热1次。患者3岁时(2008年2月)时因腹胀于当地医院诊断为“阑尾周围脓肿”,行阑尾切除术,术后出现手术切口感染,经抗感染治疗后好转,当时外周血中心粒细胞(ANC)2.3×10⁹/L。7周岁以后患者发病频率较前明显减少,发热频次为2-3次/年。2年前(2019年4月)患者再次发热(Tmax39℃),血常规示ANC 0.1×10⁹/L,胸部CT(图1):右肺中叶实变,左肺尖后段支气管扩张、纵隔淋巴结肿大,行支气管检查,提示各叶段支气管黏膜充血水肿,隆突上气管右壁可见一异常开口似右上叶尖后段,右中叶支气管管口肿胀并稀薄痰液附着,诊断为“迁延性肺炎”,予万古霉素联合美罗培南抗感染治疗后体温恢复正常,出院时复查ANC 0.3×10⁹/L,此次住院期间曾行骨髓穿刺涂片及活检未明确血液系统疾病。半月余前(2021年2月20日)患者再次出现发热,咳嗽,2021年2月27日起在当地医院住院治疗,血常规ANC 0.04×10⁹/L,胸部CT(图2):右肺上叶团块状高密实影,其内密度欠均匀,可见部分充气支气管影,病灶内可见多发类圆形稍低密度影,边缘可见多发斑片状磨玻璃密度,边界不清,临近胸膜增厚,胸膜外脂肪间隙存在,右肺中叶及左肺上叶尖后段可见小片状及条索状高密度影,边界欠清,临近支气管扩张,支气管镜肺泡灌洗液(BALF)培养:金黄色葡萄球菌,BALF细胞分类:淋巴细胞39%,巨噬细胞59%,中性粒细胞约2%,嗜酸性粒细胞<1%。予哌拉西林4g q12h抗感染治疗,患者仍发热,体温最高38.6℃,伴有畏寒、寒战、纳差、恶心,呕吐2次,均为胃内容物。3月10日转入我院。
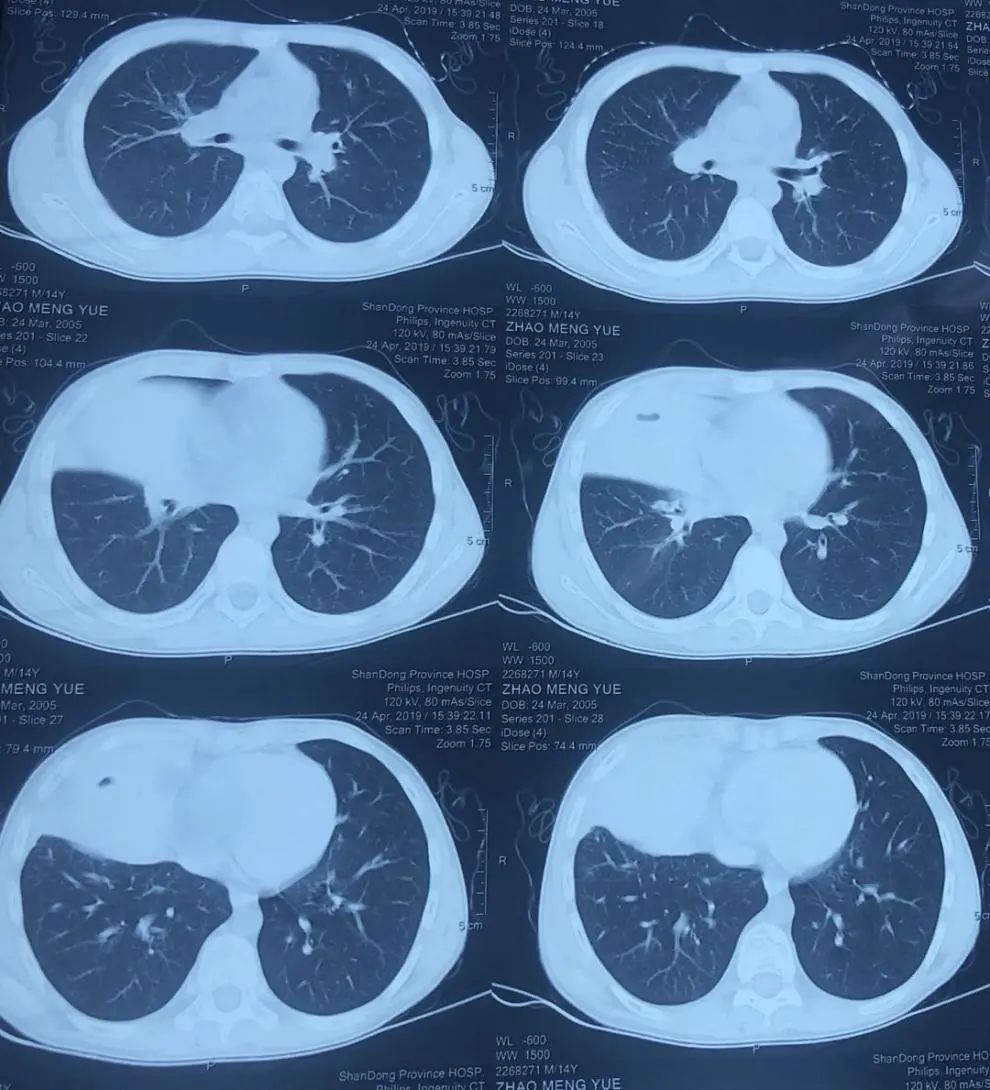
图1:胸部CT(2019年4月24日)
其他情况:患者自换牙后反复齿龈炎,现多个牙齿松动,牙菌斑较重,反复口腔溃疡;2年前左侧淋巴结肿大,抗炎治疗后不消退,于当地医院手术切除,局部留有疤痕;家属诉自幼皮肤损伤(输液针部位、蚊虫叮咬后(图3)等)后需较长时间愈合。
患者自14岁至今多次查ANC为0.01~0.49×10⁹/L,Hb 85 ~98g/L,淋巴细胞及血小板水平正常,间断予抗感染、粒细胞集落刺激因子(G-CSF)治疗,因贫血曾口服利血生及其他多种药物。
入院查体:T 37.0℃,P 60次/分,R 20次/分,Bp 120/80mmHg。一般状况尚可,轻度贫血貌,身材较同龄矮小(147.5cm,体重35Kg,BMI 16.1kg/m²),颏下、颌下淋巴结可触及,较大者位于右侧颏下,大小约2cm×2cm,质软,左侧颌下可见一长约3cm术痕,双肺呼吸音粗,未及干湿啰音,心率60次/分,律齐,未及杂音及额外心音,腹部平坦,腹软,无压痛、反跳痛,肝脾未触及,右下腹可见一长约8cm术痕,局部有瘢痕;双下肢不肿。
入院诊断:肺炎,粒细胞缺乏症。
入我院后为明确感染病原学,并查找粒细胞缺乏病因进行了以下检查。
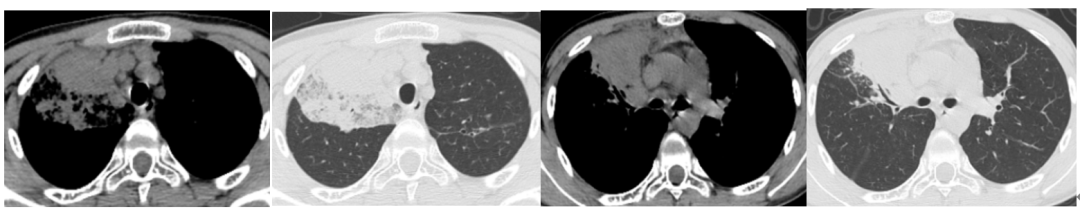
图2:胸部CT(2021.2.27)右肺上叶可见团块状高密实影,其内密度欠均,可见部分充气支气管影,病灶内可见多发类圆形稍低密度
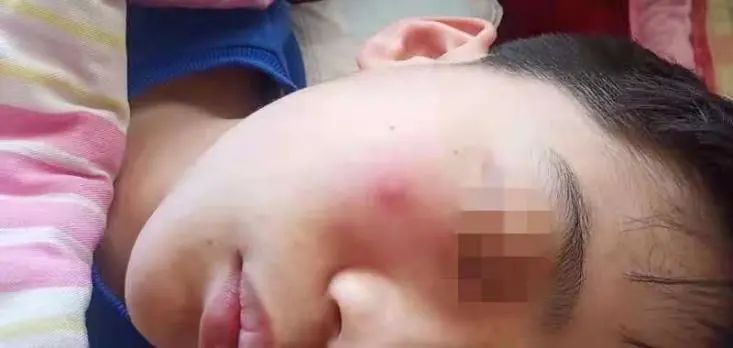
图3:颜面部蚊虫叮咬后
多次外周血常规ANC、WBC计数(包含既往追踪到所有化验结果)如图4。外周血涂片:中性粒细胞4%↓、淋巴细胞31%、单核细胞55%、嗜酸细胞8%↑;血沉95mm/h↑ ;C-反应蛋白126mg/L ↑。肝、肾功能正常。尿便常规均为阴性。
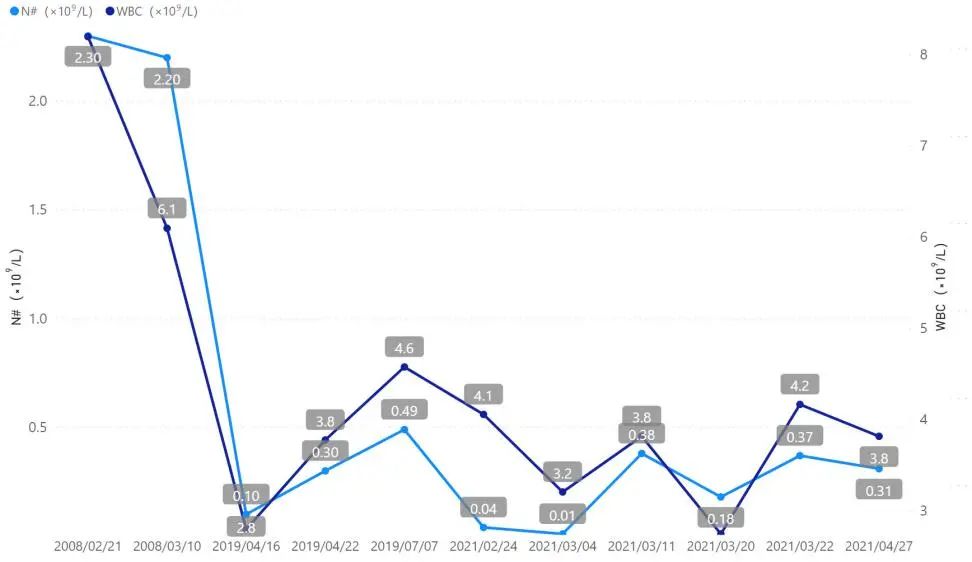
图4:自2008.2.21年至2021.4.27多次血常规中性粒细胞及白细胞变化曲线
气管镜检查,镜下表现:气管通畅,粘膜光滑,软骨环存在,隆突锐利;右上叶尖段支气管开口变异,左右主支气管及双侧各叶段支气管粘膜光滑、可见少许白色稀薄痰液,予以吸除,管腔通畅,未见明显新生物及阻塞。BALF细胞学:大量淋巴细胞及少量中性粒细胞。BALF细菌培养:金黄色葡萄球菌及流感嗜血杆菌(药敏结果见图5),余阴性。经皮肺穿刺组织病原均为阴性。经皮肺穿刺活检病理:送检小条增生的纤维组织呈慢性炎,另见少量肺组织,肺泡间隔内可见较多淋巴细胞、浆细胞浸润至肺泡间隔增宽,并伴肺泡上皮增生,肺泡腔内少许泡沫样组织细胞聚集,偶见一个Masson小体。


图5:BALF 细菌培养结果
患者自幼反复感染,伴中性粒细胞减少,考虑存在免疫缺陷,予以评估免疫功能,并寻找中性粒细胞减少原因。
免疫球蛋白+补体C3、C4:免疫球蛋白G 3840 mg/dl↑,免疫球蛋白A 1170 mg/dl↑,免疫球蛋白M 155 mg/dl,补体C3 124 mg/dl,补体C4 11.3 mg/dl↓;淋巴细胞亚群:淋巴细胞总数1.84*10⁹/L,T淋巴细胞1663cell/ul,T辅助/诱导826cell/ul,T抑制/杀伤719cell/ul,Th/Ts 1.15,B1 2.38%↑,B2 4.69%,自然杀伤细胞及活性(NK)45 cell/ul(参考值150-1000)↓,NK%2.5%(参考值5.7-30.9);Lambda轻链(血)1510mg/dl↑;Kappa轻链(血)3160mg/dl↑。抗核抗体谱:抗中性粒细胞胞浆抗体1:10阳性。甲功五项正常。肿瘤标记物均阴性。PET-CT:右肺上叶前段实变,支气管腔狭窄,代谢不均匀增高,考虑感染性疾病;纵隔及右肺门炎性淋巴结,骨髓反应性改变,左侧颌下腺术后改变,右肺下叶后基底段局部气肿,右肺中叶及左肺上叶陈旧性病变。
骨髓穿刺涂片:取材、涂片、染色良好,增生明显活跃,M:E=0.16:1,粒细胞明显减少,早幼粒易见,成熟粒细胞缺如,嗜酸易见,单核比例增高;红系增生相对显著,以中晚、幼红为主,可见类巨变、分裂相、成熟红细胞部分轻度大小不等;巨核及血小板未见不少;浆细胞明显增多,可见双核浆细胞。NAP染色:分叶核太少,无法计数。FE染色:外铁(+),内铁阳性率2%。
免疫分型结果:成熟淋巴细胞占有核细胞比例为46.1%。CD4+T淋巴细胞占有核细胞的17.5%,TCR V β为多克隆分布。CD8+T淋巴细胞占有核细胞的17.5%,TCR V β为多克隆分布。结果分析:未见明显异常T淋巴细胞。免疫分型结果:幼稚细胞占有核细胞的0.2%,以正常前B细胞为主。幼稚细胞免疫表型为CD34±CD7-CD10+CD19+CD56-CD13±CD33-CD117±CD2-CD64-CD14-HLA-DR+CD45±。另见粒细胞占有核细胞的7.5%,比例明显降低。结果分析:幼稚细胞未见明显异常。
骨髓活检:(右侧髂后)骨穿标本满意。骨髓增生活跃,有核细胞成分约占80%,粒系增生减低,各阶段均可见,嗜酸性粒细胞略多;红系增生显著,以中、晚幼红为主,造红岛扩大;巨核系数量不少,形态未见著变;髓腔内可见较多淋巴细胞及浆细胞。免疫组化结果:CD138(+),CD20(散在+),CD3(散在+),CD5(散在+),CD235a(红系+),CD61(巨核系+),CD79α(散在+),CD34(个别+),MPO(髓系+),PGM-1(+),CD10(少数+),CD117(-),TdT(少数+)。特殊染色结果:网织(+)。
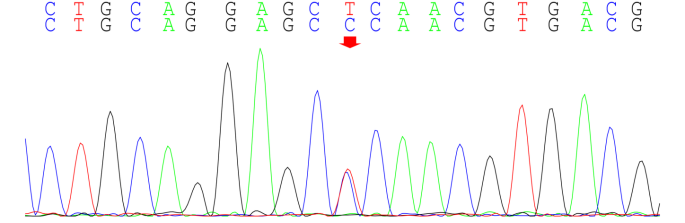
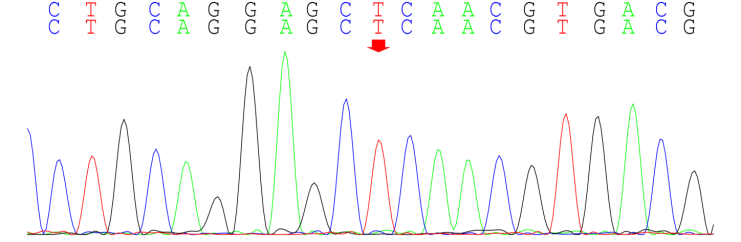
患者免疫球蛋白明显升高,但未发现自身免疫性疾病、淋巴瘤及其他浆细胞病证据,考虑血免疫球蛋白升高继发于反复慢性感染可能。患者自幼出现粒细胞减少,先后两次骨髓涂片、流式及活检结果未见血液系统恶性疾病证据,考虑存在先天性中性粒细胞减少可能。送检外周血全外显子区域二代测序和37个线粒体mtDNA二代测序,结果见表1:携带ELANE基因第4外显子c.515T>C(p.Leu172Pro)杂合突变。
表1:患者变异位点分析

A
B
C
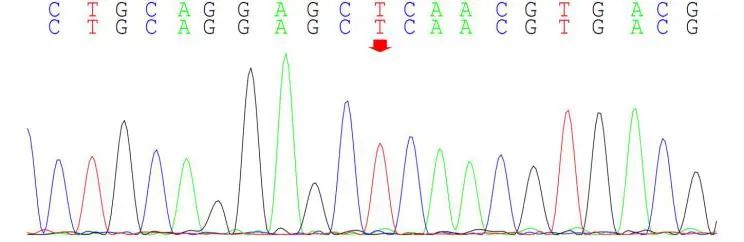
图6:ELANE 基因测序结果 A、患者存在c.515T>C杂合变异(红粗简头处示突变位点);B、患者父亲未见变异;C、患者母亲未见变异
患者住院期间出现严重粒细胞缺乏,间断予重组人粒细胞集落刺激因子(G-CSF)200ug,皮下注射。根据两种细菌药敏结果,选择美罗培南1g q8h ivgtt,用药过程中患者反复出现心律失常,与临床药师及微生物室专家沟通后,结合该患者年龄、体重及既往用药史,告知家属使用氟喹诺酮可能出现的不良反应,予头孢唑林1g q8h,左氧氟沙星(10mg/kg/d)400mg qd,患者咳嗽、气短症状明显好转,静脉输注1周后出院,院外继续口服头孢呋辛0.5g tid,甲磺酸左氧氟沙星片0.4g qd,1周后停药;出院1月后复查胸部CT病变基本吸收,血常规ANC 0.31×10⁹/L。患者自幼出现发热后即前往当地诊所输注广谱抗生素,这可能是患者未出现致命性脓毒症的原因。出院前给予生活指导,如避免进食生冷食物、避免前往人口聚集的地方,出门戴口罩,饭后漱口水漱口、定期看牙医等。患者存在先天性中性粒细胞减少,与血液科沟通治疗方案,此类病例骨髓移植预后较好,建议择期骨髓移植。
先天性粒细胞减少症(Congenital Neutropenia,CN)是一种罕见的先天性骨髓衰竭性疾病,以基因缺陷所致外周循环血中的ANC减少为主要特征的一组异质性疾病,伴或不伴造血及免疫系统外的异常[1],于1956年最早被Kostmann报道[2]。国外报道CN患病率为0.7/100万~1.0/100万[1],目前国内缺乏患病率数据,有关该病例文献多为个案报道,且多发表在儿科及遗传学相关杂志[3-5]。
国内外关于粒细胞减少症有明确的定义[6]:新生儿ANC<2.5×10⁹/L,~12月龄婴儿ANC<2.0×10⁹/L,>1岁的儿童或成年人ANC<1.5×10⁹/L。CN患者外周血ANC减少,可成持续性、间歇性或周期性,根据外周血中性粒细胞减少程度,可分为轻度[(1.0~1.5)×10⁹/L],中度[(0.5~1.0)×10⁹/L]和重度(≤0.5×10⁹/L)[7],本例患者为持续重度中性粒细胞减少。中性粒细胞减少持续超过3个月则为慢性粒细胞减少症。根据临床表现的多样性分为综合征性先天性中性粒细胞减少症和非综合征性先天性中性粒细胞减少症[8]。综合征性先天性中性粒细胞减少症临床表现呈多样性,不仅表现为中性粒细胞数目减少,还可累及其他系统(血液系统、皮肤、神经系统、心脏、泌尿系统等),如糖原累积病Ib型、网状组织发育不全、X连锁中性粒细胞减少症、p14缺陷综合征、葡萄糖6磷酸酶催化亚基3缺陷综合征、Chediak-Higashi综合征(CHS)、Shwachman.Diamond综合征(SDS)等一系列疾病。非综合征性先天性中性粒细胞减少症最常见病因为ELANE突变,临床表现主要为因中性粒细胞减少或缺乏反复引起的感染,主要包括周期性中性粒细胞减少症(Cyclic neutropenia,CyN)、重型先天性中性粒细胞减少症(Severe congenital neutropenia,SCN);前者几乎均有ELANE基因突变,后者约有50%存在该基因常染色体显性杂合子突变[9,10]。
ELANE基因编码中性粒细胞内一种丝氨酸蛋白酶,即中性粒细胞弹性蛋白酶(NE),NE贮存于中性粒细胞溶酶体内,能水解细胞外基质和细菌,在中性粒细胞发挥固有免疫功能中起重要作用[9]。ELANE突变导致CN的分子机制目前尚不确定,主要有错误定位假说[11]、未折叠蛋白反应(UPR)假说[12,13]、抑制假说[14]三种假说,后者主要解释了CyN的发病机制。
ELANE基因突变导致重度粒细胞减少(severe congenital neutropenia,SCN),呈常染色体显性遗传、常染色体隐性遗传或散发性,以点突变居多,目前已发现超过100个突变位点,散布于组成该基因的5个外显子区域,此外还有插入突变、移码突变、无义突变、剪切位点突变、转录起始位点变异以及5'端增强子区域变异[15]。
回顾病例,该患者自出生40天开始反复发热,肺部感染,皮肤、腹腔感染、淋巴结肿大、口腔溃疡、生长迟缓等,多次就诊于当地乡村诊所,因该病罕见,临床医生对该病的认识不足,缺乏诊断经验和条件,未予系统诊治。最早追踪到患者3岁时因腹腔脓肿住院,当时外周血ANC为正常下限。14岁时因肺炎就诊,发现粒细胞重度减少,就诊多家医院除外血液系统疾病,仍未能明确诊断。入我院后,经详细询问病史及复习既往辅助检查,并初步排除自身免疫性疾病及恶性疾病,行全部基因外显子区域二代测序和37个线粒体mtDNA二代测序,发现ELANE基因突变(c.515T>C),得以确诊。该患者其父母基因检测表型均正常,考虑该患者为无遗传背景散发病例。
严重慢性粒细胞减少治疗的关键在于预防感染。是否选择抗菌素预防取决于CN患者的个体风险、病史和疾病严重程度,有文献推荐推荐口服磺胺甲恶唑/甲氧苄啶(SMZ/TMP)50mg/kg/d[16]。对ELANE基因突变患者的研究表明,白血病发病的主要危险因素是中性粒细胞减少症的严重程度,而不是ELANE突变的性质。因此,在周期性中性粒细胞减少症中,白血病的风险非常低或不存在,而在ACN低于0.1×10⁹/L的患者中,白血病的风险较大。其他一些因素与白血病亦相关,如感染和G-CSF的使用,特别是高剂量 (>15μg/kg/天)和长时间使用[17]。该患者住院期间,因CN0.18×10⁹/L,予重组人粒细胞刺激因子100ug/天,连续3日,复查CN0.37×10⁹/L,整个病程中间断低剂量使用,目前骨髓涂片及活检并未提示有白血病倾向。
由于G-CSF的治疗效果,干细胞移植(HSCT)不再对挽救重度粒细胞减少患者至关重要,主要适用于G-CSF治疗效果欠佳及已转化AML及MDS患者,但是何时为干细胞移植的最佳时机尚未有定论。HSCT对未发生恶变的患者治疗后效果理想,无病生存率可达75%,移植成功的患者若外周血中性粒细胞数量恢复正常,则不再需要使用G-CSF[18,19]。因该患者对G-CSF治疗效果不理想,建议其行干细胞移植,家属因经济原因及对干细胞移植风险不能承受,暂未决心行HSCT。
参考文献(上下滑动)
[1] Dale DC, Cottle TE, Fier CJ, et,al. Severe chronic neutropenia:treatment and follow-up of patients in the Severe Chronic Neutropenia International Registry. Am J Hematol. 2003 Feb;72(2):82-93. doi:10.1002/ajh.10255. PMID: 12555210.
[2] Kostmann R.Infantile genetic agranulocytosis;agranulocytosis infanfilis hereditaria[J].Acta Paediatr Suppl,1956,45(Suppl105):l-78.
[3]侯佳,王莹,刘丹如,等.中性粒细胞弹性蛋白酶基因突变致先天性粒细胞减少症2例并文献复习[J].中国循证儿科杂志,2014,(3):172-176.
[4]唐秋雨,薛述芳,陈燕玲,陈鲁闽.ELANE相关先天性中性粒细胞减少症一例并文献复习[J].中国小儿急救医学,2020,27(10):789-792.
[5] 刘晖,刘光华,徐两蒲,等.两例ELANE基因突变所致先天性中性粒细胞减少患者的临床及遗传学分析[J].中华医学遗传学杂志,2020,37(10):1097-1100.
[6] Lanini LLS, Prader S, Siler U, Reichenbach J. Modern management of phagocyte defects. Pediatr Allergy Immunol 2017: 28: 124-134.
[7] 赵馨.获得性中性粒细胞减少症的再认识[J].国际输血及血液学杂志,2013,36(6):558-561.
[8] Donadieu J,Beaupain B,Mahlaoui N,ect.Epidemiologyof congeniml neutropenia[J].Hematol Oncol Clin North Am,2013,27(1):l-17.
[9] Dale DC, Person RE, Bolyard AA, et,al. Mutations in the geneencoding neutrophil elastase in congenital and cyclic neutropenia.Blood. 2000 Oct 1;96(7):2317-22. PMID: 11001877.
[10] Lanini LL, Prader S, Siler U, Reichenbach J. Modern management ofphagocyte defects. Pediatr Allergy Immunol. 2017 Mar;28(2):124-134.doi: 10.1111/pai.12654. Epub 2016 Oct 13. PMID: 27612320
[11] Horwitz MS, Corey SJ, Grimes HL,et,al. ELANE mutations in cyclic andsevere congenital neutropenia: genetics and pathophysiology. HematolOncol Clin North Am. 2013 Feb;27(1):19-41, vii. doi:10.1016/j.hoc.2012.10.004. Epub 2012 Nov 7. PMID: 23351986; PMCID:PMC3559001.
[12] Nustede R, Klimiankou M, Klimenkova O, et,al. ELANE mutant-specificactivation of different UPR pathways in congenital neutropenia. Br JHaematol. 2016 Jan;172(2):219-27. doi: 10.1111/bjh.13823. Epub 2015Nov 16. PMID: 26567890.
[13] Grenda DS, Murakami M, Ghatak J, et,al. Mutations of the ELA2 genefound in patients with severe congenital neutropenia induce theunfolded protein response and cellular apoptosis.Blood.2007 Dec15;110(13):4179-87. doi: 10.1182/blood-2006-11-057299. Epub 2007 Aug30. PMID: 17761833; PMCID: PMC2234798.
[14] Salipante SJ, Rojas ME, Korkmaz B, .et,al.Contributions toneutropenia from PFAAP5 (N4BP2L2), a novel protein mediatingtranscriptional repressor cooperation between Gfi1 and neutrophilelastase. Mol Cell Biol. 2009 Aug;29(16):4394-405. doi:10.1128/MCB.00596-09. Epub 2009 Jun 8. PMID: 19506020; PMCID:PMC2725743.
[15] Touw IP. Game of clones: the genomic evolution of severe congenitalneutropenia. Hematology Am Soc Hematol Educ Program. 2015;2015:1-7.doi: 10.1182/asheducation-2015.1.1. PMID: 26637693.
[16] Donadieu J, Fenneteau O, Beaupain B, et ,al. Congenital neutropenia:diagnosis, molecular bases and patient management. Orphanet J RareDis. 2011 May 19;6:26. doi: 10.1186/1750-1172-6-26. PMID: 21595885;PMCID: PMC3127744.
[17] Donadieu J, Leblanc T, Bader MB, et al. Analysis of risk factors formyelodysplasias, leukemias and death from infection among patientswith congenital neutropenia. Experience of the French Severe ChronicNeutropenia Study Group. Haematologica 2005, 90:45-53.
[18] Zeidler C, Nickel A, Sykora KW, et ,al. Improved outcome of stemcell transplantation for severe chronic neutropenia with or withoutsecondary leukemia: a long-term analysis of European data for morethan 25 years by the SCNIR. Blood. 2013; 122:3347.
[19] 孟新,侯佳,张萍,等.先天性中性粒细胞减少症研究进展[J].中国循证儿科杂志,2018,13(4):310-318.
作者简介

吴海玲
北京老年医院呼吸二科,副主任医师,毕业于吉林大学白求恩医学部,首都医科大学在读博士,主要研究方向是肺部感染性疾病、肺部肿瘤等呼吸系统常见疾病。主持院内课题1项,在核心期刊发表医学论文数篇。参与老年医学编著3部。中国老年医学学会老年医疗机构管理分会委员、北京医学会老年医学分会危重症学组委员。实用新型专利2项。

王夏珍
医学硕士,2014年毕业于哈尔滨医科大学,2014年于长治市人民医院参加工作于今。2020年参加呼吸与危重症医学专科医师规范化培训,中日友好医院PCCM 第1年学员。

崔晓敬
医学博士,中日友好医院呼吸中心呼吸与危重症医学科主治医师,2018年通过呼吸与危重症专科医师考核 。北京防痨协会临床分会委员,中国防痨协会中西医结合分会委员,全国结核综合质控专家委员会委员。
END
作者|吴海玲、王夏珍、崔晓敬
审校|王一民




